题目内容
1.防治环境污染,改善生态环境已成为全球的共识.①空气质量报告的各项指标可以反映出各地空气的质量.下列气体已纳入我国空气质量报告的是B (填字母).
A.CO2 B.NO2 C.N2
②垃圾应分类收集.导致“白色污染”的生活垃圾应放置于贴有a (填字母)标志的垃圾筒内.

③工业废水需处理达标后才能排放.下列废水处理的方法合理的是B (填字母).
A.用氯气除去废水中的悬浮物
B.用中和法除去废水中的酸
C.用混凝剂除去废水中的重金属离子.
分析 ①空气质量报告的主要内容包括:空气污染指数、首要污染物(包括可吸入颗粒物、二氧化硫、二氧化氮等气体)、空气质量级别、空气质量状况等;
②“白色污染”的生活垃圾--塑料属于可回收垃圾;
③A.混凝剂适用于除去废水中的悬浮物;
B.中和法适用于除去废水中的酸;
C.沉淀法适用于除去废水中的重金属离子.
解答 解:①空气质量报告的主要内容包括:空气污染指数、首要污染物(包括可吸入颗粒物、二氧化硫、二氧化氮等气体)、空气质量级别、空气质量状况等,
故选:B;
②“白色污染”的生活垃圾---塑料属于可回收垃圾,故选:a;
③A.废水中的悬浮物,常用混凝剂,故A不选;
B.中和法适用于除去废水中的酸,故B选;
C.沉淀法适用于除去废水中的重金属离子,故C不选;
故选:B.
点评 本题考查了生活中的化学,熟悉常见的环境污染与治理方法即可解答,题目难度不大.

练习册系列答案
相关题目
11.某化学兴趣小组对碳、氮、磷等常见元素的化合物性质进行如下研究.请按要求回答问题.
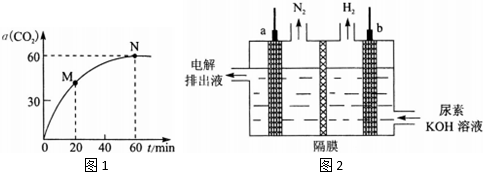
(1)甲同学用图l所示装置(部分夹持装置略)探究NO与Na2O2的反应.
查阅资料:
2NO+Na2O2═2NaNO2
6NaNO2+3H2SO4═3Na2SO4+2HNO3+4NO↑+2H2O
酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2-
①A中反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O.B中观察到的主要现象是铜片逐渐溶解,溶液变为蓝色,有无色气泡产生,F装置的作用是吸收未反应的NO.
②在反应前,打开弹簧夹,通入一段时间N2,目的是将装置中的空气排净.
③充分反应后,检验D装置中发生反应的实验是取D装置中是产物少许于试管中,加稀硫酸,若产生无色气体,遇到空气变为红棕色,则产物为亚硝酸钠.
(2)乙同学查阅有关弱酸的电离平衡常数:
则该温度下相同pH的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的物质的量浓度由大到小的顺序为a>d>b>c(填编号).
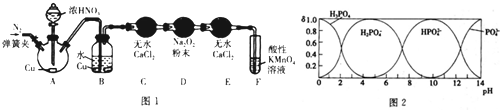
(3)磷酸(H3PO4)为一种三元酸,其在水溶液中各种存在形式物质的量分数(δ) 随pH的变化曲线如图2:
①Na3PO4溶液中,C(Na+)/c(PO43-)>3(填“>”“=”或“<”).向Na3PO4,溶液中滴入稀盐酸后,pH从10降低到5的过程中发生的主要反应的离子方程式为HPO42-+H+=H2PO4-.
②由图推断NaH2PO4溶液中各种微粒浓度关系是AD.(填选项字母)
A.c(Na-)>c(H2PO4-)>c(H+)>c(HPO42-)>c(H3PO4)
B.c(Na+)>c(H2PO4-)>c(OH-)>c(H3PO4)>c(HPO42-)
C.c(H-)+c(Na-)=c(OH)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)+c(H3PO4)
D.c(Na+)=c(H2PO4-)+c(HPO42-)+c(PO43-)+c(H3PO4)
③假设在25℃时测得0.1mol•L-1Na3PO4溶液的pH=12,近似计算出Na3PO4第一步水解的水解常数(用Kh表示) Kh=1.1×10 -3mol•L-1(忽略Na3PO4第二、第三步水解,结果保留两位有效数字).
(1)甲同学用图l所示装置(部分夹持装置略)探究NO与Na2O2的反应.

查阅资料:
2NO+Na2O2═2NaNO2
6NaNO2+3H2SO4═3Na2SO4+2HNO3+4NO↑+2H2O
酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2-
①A中反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O.B中观察到的主要现象是铜片逐渐溶解,溶液变为蓝色,有无色气泡产生,F装置的作用是吸收未反应的NO.
②在反应前,打开弹簧夹,通入一段时间N2,目的是将装置中的空气排净.
③充分反应后,检验D装置中发生反应的实验是取D装置中是产物少许于试管中,加稀硫酸,若产生无色气体,遇到空气变为红棕色,则产物为亚硝酸钠.
(2)乙同学查阅有关弱酸的电离平衡常数:
| 化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×108 | 4.9×10-10 | K1=4.3×10-7 K1=5.6×10-11 |
(3)磷酸(H3PO4)为一种三元酸,其在水溶液中各种存在形式物质的量分数(δ) 随pH的变化曲线如图2:
①Na3PO4溶液中,C(Na+)/c(PO43-)>3(填“>”“=”或“<”).向Na3PO4,溶液中滴入稀盐酸后,pH从10降低到5的过程中发生的主要反应的离子方程式为HPO42-+H+=H2PO4-.
②由图推断NaH2PO4溶液中各种微粒浓度关系是AD.(填选项字母)
A.c(Na-)>c(H2PO4-)>c(H+)>c(HPO42-)>c(H3PO4)
B.c(Na+)>c(H2PO4-)>c(OH-)>c(H3PO4)>c(HPO42-)
C.c(H-)+c(Na-)=c(OH)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)+c(H3PO4)
D.c(Na+)=c(H2PO4-)+c(HPO42-)+c(PO43-)+c(H3PO4)
③假设在25℃时测得0.1mol•L-1Na3PO4溶液的pH=12,近似计算出Na3PO4第一步水解的水解常数(用Kh表示) Kh=1.1×10 -3mol•L-1(忽略Na3PO4第二、第三步水解,结果保留两位有效数字).
16.青藤碱具有驱风寒湿、活血止痛的功效,其结构简式如图所示,下列说法正确的是( )
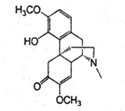

| A. | 每个青藤碱分子中含有2个手性碳原子 | |
| B. | 1mol最多能与1molBr2发生反应 | |
| C. | 1mol最多能与4molH2发生反应 | |
| D. | 青藤碱既能与盐酸反应又能与NaOH溶液反应 |
8.常温下,下列有关叙述正确的是( )
| A. | 0.1 mol/L NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | pH均为11的下列溶液:①NaOH ②KHCO3③CH3COONa,其浓度大小:①>③>② | |
| D. | 常温下NaB溶液的pH=8,则c(Na+)-c(B-)=9.9×10-7 mol/L |
5.下列仪器的使用、实验药品选择或实验结果正确的是( )
| A. | 分液漏斗中盛放液体的总体积不得超过其容量的$\frac{2}{3}$ | |
| B. | 某学生用广泛pH试纸测得某溶液的pH为0 | |
| C. | 实验室制取乙酸乙酯用稀硫酸做催化剂效果会更好 | |
| D. | 焰色反应实验,所用铂丝先用盐酸洗涤并在酒精灯火焰上灼烧 |
6. 25℃时,将氨水与氯化铵溶液混合得到 c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )
25℃时,将氨水与氯化铵溶液混合得到 c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )
 25℃时,将氨水与氯化铵溶液混合得到 c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )
25℃时,将氨水与氯化铵溶液混合得到 c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )| A. | W点表示溶液中:c(NH4+)+c(H+)=c(OH-) | |
| B. | pH=10.5溶液中:c(Cl-)+c(OH-)+c(NH3•H2O)<0.1 mol•L-1 | |
| C. | pH=9.5溶液中:c(NH3•H2O)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 向W点所表示1L溶液中加入0.05molNaOH固体(忽略溶液体积变化):c(Cl-)>c(Na+)>c(OH-)>c(NH4+)>c(H+) |
 .
.