题目内容
20.已知NaHSO3 溶液显酸性,溶液中存在以下平衡:HSO3-+H2O?H2SO3+OH- ①
HSO3-?H++SO32-②
向0.1mol/L 的NaHSO3 溶液中分别加入以下物质,下列有关说法正确的是( )
| A. | 加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 | |
| B. | NaHSO3 溶液中,c(H2SO3)>c(SO32-),加水稀释后离子浓度均减小 | |
| C. | 加入少量NaOH溶液,$\frac{c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$减小,$\frac{c(O{H}^{-})}{c({H}^{+})}$的值增大 | |
| D. | 加入氨水至中性,则c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) |
分析 A、加入金属钠,先和水反应生成氢氧化钠和氢气,氢氧化钠抑制水解平衡①促进电离平衡②;
B、依据溶液显示酸性,则HSO3-的电离程度大于水解程度,加水稀释,酸性减弱,据此回答;
C、加入氢氧化钠促进电离平衡右移,抑制水解平衡左移;
D、依据溶液中的物料守恒分析比较.
解答 解:A、加入少量金属Na,Na与HSO3-电离出的H+反应,促使平衡②右移,HSO3-离子浓度减小,又促使平衡①左移,平衡①左移,平衡②右移,溶液中c(HSO3-)浓度减小,故A错误;
B、依据溶液显示酸性,则HSO3-的电离程度大于水解程度,c(H2SO3)>c(SO32-),加水稀释后大多数离子浓度均减小,但是氢氧根离子浓度会增加,故B错误;
C、加入氢氧化钠促进电离,平衡右移,抑制水解,平衡左移,c(SO32-),c(OH-)浓度增大,$\frac{c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$减小,$\frac{c(O{H}^{-})}{c({H}^{+})}$的比值增大,故C正确;
D、加入氨水至中性,c(H+)=c(OH-),根据物料守恒可得:c(Na+)=c(H2SO3)+c(SO32-)+c(HSO3-),故D正确;
故选CD.
点评 本题考查电解质溶液,涉及弱电解质的电离和盐类的水解、三大守恒关系的应用,平衡分析和溶液中离子浓度关系判断是解题关键,题目难度中等.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
11.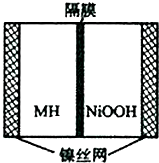 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).该电池放电时的总反应为:MH+NiOOH=M+Ni(OH)2,下列有关说法不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).该电池放电时的总反应为:MH+NiOOH=M+Ni(OH)2,下列有关说法不正确的是( )
 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).该电池放电时的总反应为:MH+NiOOH=M+Ni(OH)2,下列有关说法不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).该电池放电时的总反应为:MH+NiOOH=M+Ni(OH)2,下列有关说法不正确的是( )| A. | 放电时负极反应为:MH+OH--e-→M+H2O | |
| B. | 电池的电解液可为KOH溶液,OH-向负极移动 | |
| C. | 放电时正极反应为:NiOOH+H2O-e-→Ni(OH)2+OH- | |
| D. | MH是一类储氢材料,其氢密度越大,电池的能量密度越高 |
15.W、R、X、Y、Z是五种短周期元素,部分信息如表所示:
请回答下列问题:
(1)Z的元素符号可能是H、Be、Al;
(2)XW3能使红色湿润石蕊试纸变蓝色;
(3)Y和R元素组成常见的化合物的化学式为CO2或SiO2;
(4)画出Y的简单离子结构示意图: .
.
| 元素代号 | 部分信息 |
| W | W是一种核素没有中子 |
| R | R原子的最外层电子数等于K层电子数的2倍 |
| X | X原子得到3个电子达到稳定结构,单质在常温、常压下呈气态 |
| Y | Y原子的最外层电子数是电子层数的3倍 |
| Z | Z原子的电子层数等于最外层电子数 |
(1)Z的元素符号可能是H、Be、Al;
(2)XW3能使红色湿润石蕊试纸变蓝色;
(3)Y和R元素组成常见的化合物的化学式为CO2或SiO2;
(4)画出Y的简单离子结构示意图:
 .
.
5.下列关于实验的说法正确的是( )
| A. | 为测定某NaOH溶液的浓度,通常用已润洗的酸式滴定管放出25.00mL标准盐酸溶液于锥形瓶中,加2滴酚酞,然后向已润洗的碱式滴定管中注入未知浓度的NaOH溶液进行滴定 | |
| B. | 用无水CuSO4 、BaCl2溶液、稀盐酸、NaOH溶液、红色石蕊试纸、KSCN溶液、新制氯水等试剂可确定摩尔盐的化学式 | |
| C. | 通常采用产生气泡的快慢,来比较不同条件下Na2S2O3溶液与稀硫酸的反应速率 | |
| D. | 萃取操作所用的分液漏斗使用前应加入少量水,见旋塞芯处是否漏水,待确认不漏水后则可以使用 |
12.下列说法不正确的是( )
| A. | 为除去FeSO4溶液中的Fe2(SO4)3,可加入铁粉,再过滤 | |
| B. | 为除去溴苯中的溴,可用NaOH溶液洗涤,再分液 | |
| C. | 为除去乙炔气中少量的H2S,可使其通过CuSO4 溶液 | |
| D. | 为除去CO2 中少量的SO2 ,可使其通过饱和Na2CO3溶液 |
8.下列说法正确的是( )
| A. | 分子式为C10H1202的有机物,①苯环上有两个取代基,②能与NaHCO3反应生成气体,满足以上2个条件的该有机物的同分异构体有15种 | |
| B. | 分子式为C4H8Cl2机物,只含有一个甲基的同分异构体有7种 | |
| C. | 分子式为C4H10O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| D. |  分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
9.H、C、N、Cl、Na、Al是常见的六种元素
(1)H位于元素周期表第1周期第ⅠA族;C的基态原子核外有2对成对电子;
Cl原子的价电子表示式3S23P5.
(2)用“>”、“=”、“<”填空
(3)用电子式表示Na Cl的形成过程: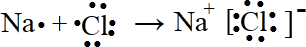 .
.
(4)已知在常温常压下:
写出H2与Cl2反应的热化学方程式:H2(g)+Cl2(g)═2HCl(g)△H=(a+c-2b)kJ•mol-1;.
(1)H位于元素周期表第1周期第ⅠA族;C的基态原子核外有2对成对电子;
Cl原子的价电子表示式3S23P5.
(2)用“>”、“=”、“<”填空
| 稳定性 | 得电子能力 | 离子半径 | 电负性 |
| CH4<NH3 | 1H=2H | Na+>Al3+ | C>Al |
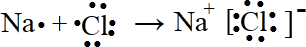 .
.(4)已知在常温常压下:
| 化学键 | H-H | H-Cl | Cl-Cl |
| 键能kJ/mol | a | b | c |
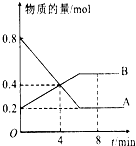 某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据
某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据