题目内容
18.下列叙述正确的有( )①Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合价制得
②灼热的炭与CO2的反应、Ba(OH)2•8H2O与NH4Cl的反应均既属于氧化还原反应,又是吸热反应
③碘晶体分散到酒精中、饱和氯化铁溶液滴入沸水中所形成的分散系分别为:溶液、胶体
④按照纯净物、混合物、强弱电解质和非电解质顺序排列的是单甘油酯、混甘油酯、苛性钾、次氯酸、氯气
⑤高纯度的硅单质广泛用于制作光导纤维
⑥向煤中加入适量石灰石,使煤燃烧产生的SO2最终生成CaSO4,可减少对大气的污染.
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
分析 ①由两种或两种以上的物质反应生成一种新物质的反应属于化合反应;
②有化合价变化的反应属于氧化还原反应;
③碘晶体分散到酒精中形成的分散系是溶液,饱和氯化铁溶液滴入沸水中生成氢氧化铁胶体;
④非电解质属于化合物;
⑤光导纤维的主要成分是二氧化硅;
⑥依据石灰石与煤燃烧时产生的SO2及空气中的O2反应.
解答 解:①CaCO3+CO2+H2O=Ca(HCO3)2、4Fe(OH)2+O2+2H2O=4Fe(OH)3、2FeCl3+Fe=3FeCl2均可由化合反应制得,故正确;
②Ba(OH)2•8H2O与NH4Cl的反应属于复分解反应,没有化合价变化,不属于氧化还原反应,故错误;
③碘晶体分散到酒精中形成的分散系是溶液,饱和氯化铁溶液滴入沸水中生成氢氧化铁胶体,故正确;
④氯气是单质不属于非电解质,故错误;
⑤光导纤维的主要成分是二氧化硅,不是硅,故错误;
⑥向煤中加入适量石灰石.石灰石与煤燃烧时产生的SO2及空气中的O2反应,生成CaSO4和CO2,减少二氧化硫的排放,故正确;
故选:C.
点评 本题考查了化学常见的概念,掌握氧化还原反应、化合反应、溶液、胶体、电解质、非电解质、纯净物、混合物等概念的理解和应用是解题关键,题目难度不大,注意对课本基础知识的理解.

练习册系列答案
相关题目
8.下列说法正确的是( )
| A. | 分子式为C10H1202的有机物,①苯环上有两个取代基,②能与NaHCO3反应生成气体,满足以上2个条件的该有机物的同分异构体有15种 | |
| B. | 分子式为C4H8Cl2机物,只含有一个甲基的同分异构体有7种 | |
| C. | 分子式为C4H10O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| D. |  分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
9.H、C、N、Cl、Na、Al是常见的六种元素
(1)H位于元素周期表第1周期第ⅠA族;C的基态原子核外有2对成对电子;
Cl原子的价电子表示式3S23P5.
(2)用“>”、“=”、“<”填空
(3)用电子式表示Na Cl的形成过程: .
.
(4)已知在常温常压下:
写出H2与Cl2反应的热化学方程式:H2(g)+Cl2(g)═2HCl(g)△H=(a+c-2b)kJ•mol-1;.
(1)H位于元素周期表第1周期第ⅠA族;C的基态原子核外有2对成对电子;
Cl原子的价电子表示式3S23P5.
(2)用“>”、“=”、“<”填空
| 稳定性 | 得电子能力 | 离子半径 | 电负性 |
| CH4<NH3 | 1H=2H | Na+>Al3+ | C>Al |
 .
.(4)已知在常温常压下:
| 化学键 | H-H | H-Cl | Cl-Cl |
| 键能kJ/mol | a | b | c |
3.如图为元素周期表中前四周期的一部分,下列判断正确的是( )


| A. | 气态氢化物的还原性:X>Y、M>R | B. | 原子半径:Z>M>R、M<X<Y | ||
| C. | M与Z的原子核外电子数相差16 | D. | Q的最高价氧化物一定能溶于强碱 |
7.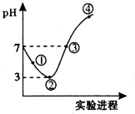 常温下,将Cl2缓慢通人100mL水中至饱和,然后向所得饱和氯水中逐滴加人0.1mol/LNaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
常温下,将Cl2缓慢通人100mL水中至饱和,然后向所得饱和氯水中逐滴加人0.1mol/LNaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
 常温下,将Cl2缓慢通人100mL水中至饱和,然后向所得饱和氯水中逐滴加人0.1mol/LNaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
常温下,将Cl2缓慢通人100mL水中至饱和,然后向所得饱和氯水中逐滴加人0.1mol/LNaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )| A. | 曲线③④段有离子反应:HClO+OH-=ClO-+H2O | |
| B. | 可依据②处数据计算所溶解的n(Cl2) | |
| C. | ③处表示氯气与氢氧化钠溶液恰好反应完全 | |
| D. | ①处c(H+)约为②处c(H+)的两倍 |
8.常温下,下列电解质溶液的有关叙述,错误的是( )
| A. | NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大 | |
| B. | 在NaHCO3溶液中:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) | |
| C. | pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)相等 | |
| D. | 0.1 mol/L 的NaOH溶液和CH3COOH溶液等体积混合,则c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
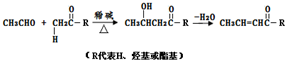
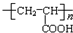 +HOCH2CH2OH
+HOCH2CH2OH +2H2O.
+2H2O. +NaOH→
+NaOH→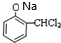 +H2O.
+H2O. .
.
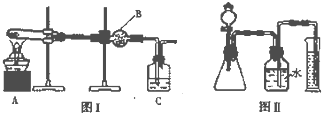 某研究性小组将一定浓度的NaCO3溶液滴入MgSO4溶液中得到白色沉淀,对于白色沉淀的成分进行研究:
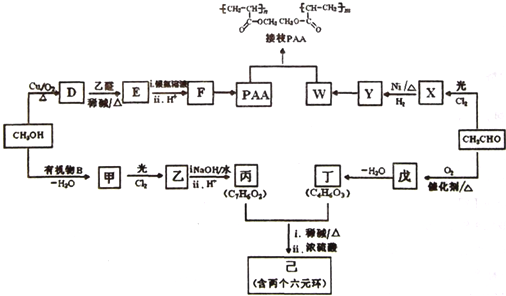
某研究性小组将一定浓度的NaCO3溶液滴入MgSO4溶液中得到白色沉淀,对于白色沉淀的成分进行研究: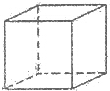 己知A、B、C、D、E、F、G、H八种元素都是周期表中前四周期的元素,它们的核电荷数依次增大,A是原子半径最小的主族元素,B有三种不同的能级且每种能级上所含电子数相同,C的单质性质稳定且一种氢化物极易溶于水,D能形成两种互为同素异形体的气态单质,A、D、E的核内质子数之和与F的核内质子数相同,F的基态原子中有4个未成对电子,G比F原子多一个核内质子,上述H元素的+l价阳离子的K、L、M能层为全充满结构.
己知A、B、C、D、E、F、G、H八种元素都是周期表中前四周期的元素,它们的核电荷数依次增大,A是原子半径最小的主族元素,B有三种不同的能级且每种能级上所含电子数相同,C的单质性质稳定且一种氢化物极易溶于水,D能形成两种互为同素异形体的气态单质,A、D、E的核内质子数之和与F的核内质子数相同,F的基态原子中有4个未成对电子,G比F原子多一个核内质子,上述H元素的+l价阳离子的K、L、M能层为全充满结构.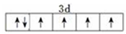 .在这两种离子之间Fe3+更稳定(填化学式):从微观结构角度解释该离子更稳定的原因:Fe3+离子的3d轨道为半满稳定状态.
.在这两种离子之间Fe3+更稳定(填化学式):从微观结构角度解释该离子更稳定的原因:Fe3+离子的3d轨道为半满稳定状态.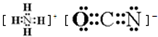
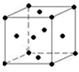 .该晶体中H原子直径为apm,H的相对原子质量为M,阿伏伽德罗常数为NA,求该晶胞密度表达式
.该晶体中H原子直径为apm,H的相对原子质量为M,阿伏伽德罗常数为NA,求该晶胞密度表达式