题目内容
20.以焦炭为主要原料合成NH3,为了使通入合成塔的N2与H2保持1:3的体积比,则焦炭(不计燃烧中的消耗)与空气的物质的量之比约为( )(N2约占空气总体积的$\frac{4}{5}$)| A. | 1:3 | B. | 3:2 | C. | 6:5 | D. | 4:3 |
分析 C+H2O=CO+H2…①;CO+H2O=CO2+H2…②,则①+②得:C+2H2O=CO2+2H2;
所以1个C对应2个H2,空气中N2含量为78%,约为$\frac{4}{5}$,为了使通入合成塔的N2与H2保持1:3的体积比,N2:H2=1:3,即:空气的物质的量×$\frac{4}{5}$:2×焦炭的物质的量=1:3,分析求解.
解答 解:C+H2O=CO+H2…①;CO+H2O=CO2+H2…②,则①+②得:C+2H2O=CO2+2H2;
所以1个C对应2个H2,空气中N2含量为78%,约为$\frac{4}{5}$,为了使通入合成塔的N2与H2保持1:3的体积比,N2:H2=1:3,即:空气的物质的量×$\frac{4}{5}$:2×焦炭的物质的量=1:3
解之得:焦炭与空气的物质的量之比约为6:5
故选:C.
点评 本题考查根据方程式进行计算的问题,学生只要学会根据方程列关系式就可以了,比较容易.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.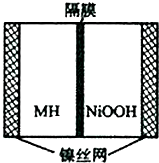 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).该电池放电时的总反应为:MH+NiOOH=M+Ni(OH)2,下列有关说法不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).该电池放电时的总反应为:MH+NiOOH=M+Ni(OH)2,下列有关说法不正确的是( )
 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).该电池放电时的总反应为:MH+NiOOH=M+Ni(OH)2,下列有关说法不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).该电池放电时的总反应为:MH+NiOOH=M+Ni(OH)2,下列有关说法不正确的是( )| A. | 放电时负极反应为:MH+OH--e-→M+H2O | |
| B. | 电池的电解液可为KOH溶液,OH-向负极移动 | |
| C. | 放电时正极反应为:NiOOH+H2O-e-→Ni(OH)2+OH- | |
| D. | MH是一类储氢材料,其氢密度越大,电池的能量密度越高 |
12.下列说法不正确的是( )
| A. | 为除去FeSO4溶液中的Fe2(SO4)3,可加入铁粉,再过滤 | |
| B. | 为除去溴苯中的溴,可用NaOH溶液洗涤,再分液 | |
| C. | 为除去乙炔气中少量的H2S,可使其通过CuSO4 溶液 | |
| D. | 为除去CO2 中少量的SO2 ,可使其通过饱和Na2CO3溶液 |
8.下列说法正确的是( )
| A. | 分子式为C10H1202的有机物,①苯环上有两个取代基,②能与NaHCO3反应生成气体,满足以上2个条件的该有机物的同分异构体有15种 | |
| B. | 分子式为C4H8Cl2机物,只含有一个甲基的同分异构体有7种 | |
| C. | 分子式为C4H10O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| D. |  分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
15.化学与生活密切相关,下列说法正确的是( )
| A. | 绿色食品是只指纯天然食品,不含任何化学物质 | |
| B. | 推广使用可降解塑料及布质购物袋,以减少“白色污染” | |
| C. | 为消除碘缺乏病,政府规定在食盐中必须添加一定量的KI | |
| D. | 只要带专用口罩,就不怕雾霾天气对人体产生伤害 |
5.相同质量的铜片分别与体积相同且过量的浓硝酸、稀硝酸反应,二者比较相等的是( )
| A. | 铜片消耗完所需时间 | |
| B. | 反应中氧化剂得到电子总数 | |
| C. | 反应后溶液中铜离子浓度(反应后溶液体积不变) | |
| D. | 反应生成气体的体积(同温、同压) |
12.下列化工生产过程中的主要反应,不涉及氧化还原反应的是( )
| A. | 制纯碱 | B. | 制烧碱 | C. | 制漂白粉 | D. | 制硝酸 |
9.H、C、N、Cl、Na、Al是常见的六种元素
(1)H位于元素周期表第1周期第ⅠA族;C的基态原子核外有2对成对电子;
Cl原子的价电子表示式3S23P5.
(2)用“>”、“=”、“<”填空
(3)用电子式表示Na Cl的形成过程: .
.
(4)已知在常温常压下:
写出H2与Cl2反应的热化学方程式:H2(g)+Cl2(g)═2HCl(g)△H=(a+c-2b)kJ•mol-1;.
(1)H位于元素周期表第1周期第ⅠA族;C的基态原子核外有2对成对电子;
Cl原子的价电子表示式3S23P5.
(2)用“>”、“=”、“<”填空
| 稳定性 | 得电子能力 | 离子半径 | 电负性 |
| CH4<NH3 | 1H=2H | Na+>Al3+ | C>Al |
 .
.(4)已知在常温常压下:
| 化学键 | H-H | H-Cl | Cl-Cl |
| 键能kJ/mol | a | b | c |
 己知A、B、C、D、E、F、G、H八种元素都是周期表中前四周期的元素,它们的核电荷数依次增大,A是原子半径最小的主族元素,B有三种不同的能级且每种能级上所含电子数相同,C的单质性质稳定且一种氢化物极易溶于水,D能形成两种互为同素异形体的气态单质,A、D、E的核内质子数之和与F的核内质子数相同,F的基态原子中有4个未成对电子,G比F原子多一个核内质子,上述H元素的+l价阳离子的K、L、M能层为全充满结构.
己知A、B、C、D、E、F、G、H八种元素都是周期表中前四周期的元素,它们的核电荷数依次增大,A是原子半径最小的主族元素,B有三种不同的能级且每种能级上所含电子数相同,C的单质性质稳定且一种氢化物极易溶于水,D能形成两种互为同素异形体的气态单质,A、D、E的核内质子数之和与F的核内质子数相同,F的基态原子中有4个未成对电子,G比F原子多一个核内质子,上述H元素的+l价阳离子的K、L、M能层为全充满结构.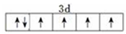 .在这两种离子之间Fe3+更稳定(填化学式):从微观结构角度解释该离子更稳定的原因:Fe3+离子的3d轨道为半满稳定状态.
.在这两种离子之间Fe3+更稳定(填化学式):从微观结构角度解释该离子更稳定的原因:Fe3+离子的3d轨道为半满稳定状态.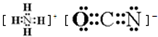
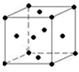 .该晶体中H原子直径为apm,H的相对原子质量为M,阿伏伽德罗常数为NA,求该晶胞密度表达式$\frac{\sqrt{2}M×1{0}^{30}}{{N}_{A}{a}^{3}}$g/cm3(用a,M,NA表示)
.该晶体中H原子直径为apm,H的相对原子质量为M,阿伏伽德罗常数为NA,求该晶胞密度表达式$\frac{\sqrt{2}M×1{0}^{30}}{{N}_{A}{a}^{3}}$g/cm3(用a,M,NA表示)