题目内容
18.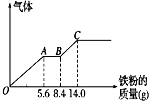 向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )
向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )| A. | OA 段产生的是 NO,BC 段产生氢气,溶液中最终溶质为 FeSO4 | |
| B. | AB 段的反应为 Fe+2Fe3+═3Fe2+, | |
| C. | 原混合酸中NO3-物质的量为 0.3mol | |
| D. | H2SO4 浓度为 2.5 mol•L-1 |
分析 由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,硝酸全部起氧化剂作用,最终为硫酸亚铁溶液,OA段消耗Fe为5.6g,根据OA段离子方程式计算原混合酸中NO3-物质的量,最终消耗Fe为14g,则n( FeSO4)=n(Fe),由硫酸根守恒n(H2SO4)=n( FeSO4),再根据c=$\frac{n}{V}$计算c(H2SO4).
解答 解:A.由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,硝酸全部起氧化剂作用,最终为FeSO4溶液,故A正确;
B.AB段发生反应为:Fe+2Fe3+=3Fe2+,故B正确;
C.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,OA段消耗Fe为5.6g,所以n(NO3-)=n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,故C错误;
D.反应消耗14g铁,物质的量为$\frac{14g}{56g/mol}$=0.25mol,则n( FeSO4)=n(Fe)=0.25mol,由硫酸根守恒n(H2SO4)=n( FeSO4)=0.25mol,则c(H2SO4)=$\frac{0.25mol}{0.1L}$=2.5mol/L,故D正确,
故选:C.
点评 本题以图象为载体,考查有关金属和酸反应的计算题,难度中等,关键根据图象分析各段发生的反应,注意与铁的反应中硝酸全部起氧化剂作用,

练习册系列答案
相关题目
8.设NA代表阿伏加德罗常数,下列关于0.2mol/L的Ba(NO3)2溶液的说法中不正确的是( )
| A. | 1L溶液中含有0.2NA个NO3- | |
| B. | 1L溶液中所含的阴、阳离子总数为0.6NA个 | |
| C. | 0.5L溶液中Ba2+浓度是0.1mol/L | |
| D. | 500mL溶液中,含有NO3-的物质的量为0.2mol |
9.现有①液态氧 ②氢氧化铁胶体 ③食盐水 ④纯碱 ⑤氢氧化钾 ⑥空气 对上述物质的分类全部正确的是( )
| A. | 盐 ③④ | B. | 混合物 ②③⑥ | C. | 纯净物 ④⑤⑥ | D. | 碱 ④⑤ |
6.25℃时,水中存在电离平衡:H2O═H++OH-△H>0.下列叙述正确的是( )
| A. | 将水加热,Kw增大,pH不变 | |
| B. | 向水中加入少量NaHSO4固体,溶液的c(H+)增大,水电离的c(H+)降低 | |
| C. | 向水中加入少量NaOH固体,平衡逆向移动,溶液的c(OH-)降低 | |
| D. | 向水中加入少量NH4Cl固体,平衡正向移动,溶液的c(OH-)增大 |
13.下列说法正确的是( )
| A. | △H>0,△S>0 的反应任何条件都是非自发反应 | |
| B. | 放热反应均能自发进行,且反应放出的热量越多,反应越完全 | |
| C. | 某反应的△H>0、△S<0,则该反应一定不能正向进行 | |
| D. | 水从固态→液态→气态的变化过程中△S>0 |
3.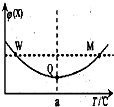 在某恒容密闭容器中充入一定量 X(g)和 Y(g),发生反应2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中 X 的体积分数与温度的 关系如图.下列推断正确的是( )
在某恒容密闭容器中充入一定量 X(g)和 Y(g),发生反应2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中 X 的体积分数与温度的 关系如图.下列推断正确的是( )
 在某恒容密闭容器中充入一定量 X(g)和 Y(g),发生反应2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中 X 的体积分数与温度的 关系如图.下列推断正确的是( )
在某恒容密闭容器中充入一定量 X(g)和 Y(g),发生反应2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中 X 的体积分数与温度的 关系如图.下列推断正确的是( )| A. | M 点时,Y 的转化率最大 | |
| B. | 升高温度,平衡常数减小 | |
| C. | 平衡后充入 Z 达到新平衡时 Z 的体积分数增大 | |
| D. | W,M 两点 Y 的正反应速率相等 |
10.下列说法正确的是( )
| A. | 根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸 | |
| B. | 酸性氧化物都是非金属氧化物 | |
| C. | Na2O熔融状态下能导电,所以Na2O是电解质 | |
| D. | 胶体区别于其他分散系的本质特征是产生丁达尔效应 |
7.对于 90℃的纯水,以下认识正确的是( )
| A. | c (H+)>10-7 mol/L>c (OH-) pH<7 显中性 | |
| B. | c (H+)=c (OH-)>10-7 mol/L pH<7 显中性 | |
| C. | c (H+)>10-7 mol/L>c (OH-) pH<7 显酸性 | |
| D. | c (H+)=c (OH-)>10-7 mol/L pH=7 显中性 |