题目内容
7.对于 90℃的纯水,以下认识正确的是( )| A. | c (H+)>10-7 mol/L>c (OH-) pH<7 显中性 | |
| B. | c (H+)=c (OH-)>10-7 mol/L pH<7 显中性 | |
| C. | c (H+)>10-7 mol/L>c (OH-) pH<7 显酸性 | |
| D. | c (H+)=c (OH-)>10-7 mol/L pH=7 显中性 |
分析 水的电离是吸热反应,升高温度促进水电离,导致纯水中c(H+)、c(OH-)都增大,但仍然存在c(H+)=c(OH-),据此分析解答.
解答 解:水的电离是吸热反应,升高温度促进水电离,导致纯水中c(H+)、c(OH-)都增大,pH<7,但仍然存在c(H+)=c(OH-),则纯水仍然呈中性,故选B.
点评 本题考查溶液酸碱性判断,为高频考点,溶液酸碱性要根据溶液中c(H+)、c(OH-)相对大小判断,温度未知时不能根据溶液的pH判断,题目难度不大.

练习册系列答案
相关题目
18.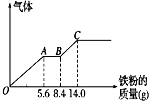 向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )
向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )
 向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )
向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )| A. | OA 段产生的是 NO,BC 段产生氢气,溶液中最终溶质为 FeSO4 | |
| B. | AB 段的反应为 Fe+2Fe3+═3Fe2+, | |
| C. | 原混合酸中NO3-物质的量为 0.3mol | |
| D. | H2SO4 浓度为 2.5 mol•L-1 |
15.为了证明某晶体中含有NH4+、K+、SO42-和H2O,下列实验叙述中不正确的是( )
| A. | 取少量晶体放入试管中,加热,若试管口上蘸有少量无水硫酸铜粉末的脱脂棉变蓝,则可证明晶体中含有结晶水 | |
| B. | 取少量晶体溶于水,加入少量NaOH溶液,加热,在试管口用湿润的蓝色石蕊试纸检验,若变红,则可证明晶体的成分中含有NH4+ | |
| C. | 取少量晶体溶于水,加适量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- | |
| D. | 取少量晶体溶于水,用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,不能证明晶体中无K+ |
2.某校化学小组学生利用如图所示装置进行“乙二酸(俗名草酸)晶体受热分解”的实验,并验证分解产物中有CO2和CO.(图中夹持装置及尾气处理装置均已略去)
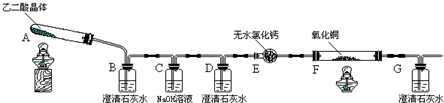
(1)装置C中盛放NaOH溶液的作用是吸收乙二酸晶体受热分解生成的二氧化碳
(2)①证明分解产物中有CO2的现象是装置B中澄清石灰水变浑浊
②证明分解产物中有CO的现象是装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊
(3)实验结束后,装置F中黑色氧化铜变为红色固体.简述检验红色固体中是否含有Cu2O的实验方法(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):取少量固体与试管中,加稀硫酸,若溶液变蓝色,说明有Cu2O,若溶液不变色,则不含有Cu2O
(4)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4、MnO2氧化.KMnO4和草酸钠在稀硫酸中反应的离子方程式是2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O.
②实验室常用草酸钠标定KMnO4溶液.操作如下:准确称取0.2000g草酸钠,放入锥形瓶中,加100mL稀硫酸溶解,用配置好的KMnO4溶液滴定.当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点.重复上述滴定操作三次,实验数据如下表所示.
KMnO4溶液的物质的量浓度的计算式是c(KMnO4)=$\frac{0.2000g×2mol}{5mol×134g/mol×0.01601L}$.

(1)装置C中盛放NaOH溶液的作用是吸收乙二酸晶体受热分解生成的二氧化碳
(2)①证明分解产物中有CO2的现象是装置B中澄清石灰水变浑浊
②证明分解产物中有CO的现象是装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊
(3)实验结束后,装置F中黑色氧化铜变为红色固体.简述检验红色固体中是否含有Cu2O的实验方法(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):取少量固体与试管中,加稀硫酸,若溶液变蓝色,说明有Cu2O,若溶液不变色,则不含有Cu2O
(4)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4、MnO2氧化.KMnO4和草酸钠在稀硫酸中反应的离子方程式是2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O.
②实验室常用草酸钠标定KMnO4溶液.操作如下:准确称取0.2000g草酸钠,放入锥形瓶中,加100mL稀硫酸溶解,用配置好的KMnO4溶液滴定.当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点.重复上述滴定操作三次,实验数据如下表所示.
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管 液面刻度 | 0.00mL | 16.02mL | 16.00mL | 16.01mL |
12.下列关于铁的描述不正确的是( )
| A. | 在FeSO4溶液中滴入KSCN溶液,溶液显红色 | |
| B. | 铁位于元素周期表中第4周期第Ⅷ族 | |
| C. | 在化合物中,铁通常呈现为+2,+3价 | |
| D. | 通常情况下,铁丝在氯气里燃烧时生成FeCl3 |
 NH4++NH2-.
NH4++NH2-.