题目内容
8.设NA代表阿伏加德罗常数,下列关于0.2mol/L的Ba(NO3)2溶液的说法中不正确的是( )| A. | 1L溶液中含有0.2NA个NO3- | |
| B. | 1L溶液中所含的阴、阳离子总数为0.6NA个 | |
| C. | 0.5L溶液中Ba2+浓度是0.1mol/L | |
| D. | 500mL溶液中,含有NO3-的物质的量为0.2mol |
分析 A.根据n=cV计算出1L该硝酸钡溶液中含有的硝酸钡的物质的量,再计算出含有的硝酸根离子的物质的量;
B.根据A可知1L该溶液中含有硝酸钡的物质的量,再计算出含有的硝酸根离子和钡离子的物质的量;
C.溶液的物质的量浓度与溶液的体积大小无关;
D.0.5L该溶液中含有0.1mol硝酸钡,含有0.2mol硝酸根离子.
解答 解:A.1L该溶液中含有0.2mol硝酸钡,含有0.4mol硝酸根离子,含有0.4NA个NO3-,故A错误;
B.1L该溶液中含有0.2mol硝酸钡,0.2mol硝酸钡中含有0.4mol硝酸根离子、0.2mol钡离子,总共含有0.6mol阴、阳离子,所以阴、阳离子总数为0.6NA个,故B正确;
C.0.5L该溶液中钡离子的浓度与硝酸钡溶液的浓度相等,都是0.2mol/L,与溶液体积无关,故C错误;
D.500mL溶液中含有硝酸钡的物质的量为:0.2mol/L×0.5L=0.1mol,0.1mol硝酸钡中含有NO3-的物质的量为0.2mol,故D正确;
故选AC.
点评 本题考查了物质的量浓度的计算与判断,题目难度中等,明确物质的量浓度的表达式为解答关键,注意熟练掌握物质的量与物质的量浓度、阿伏伽德罗常数等之间的关系,试题培养了学生的化学计算能力.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
10.如表是常温下某些一元弱酸的电离常数:
则0.1mol•L-1的下列溶液中,pH最小的是( )
| 弱酸 | HCN | HF | CH3COOH | HNO2 |
| 电离常数 | 4.9×10-10 | 7.2×10-4 | 1.8×10-5 | 6.4×10-6 |
| A. | HCN | B. | HF | C. | CH3COOH | D. | HNO2 |
19.草酸镍晶体(NiC2O4•2H2O)可用于制镍催化剂,某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下如图1:
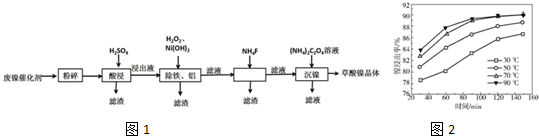
已知:①Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9.
②相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为1,.0mol•L-1计算).
(1)“粉碎”的目的是增大接触面积,加快反应速率,提高镍的浸出率.
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图2.“酸浸”的适宜温度与时间分别为c(填字母).
a.30℃、30min b.90℃、150min c.70℃、120min d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象 是静置,在上层清液中继续滴加(NH4)2C2O4溶液,若不产生沉淀,则Ni2+已经沉淀完全.将“沉镍”工序得到的混合物过滤,所得固体用75%乙醇溶液洗涤、110℃下烘干,得草酸镍晶体.用75%乙醇溶液洗涤的目的是洗去(NH4)2SO4杂质、便于烘干、减少草酸镍晶体损失.
(4)在除铁和铝工序中,应先加入H2O2氧化,再加氢氧化镍调节pH值的范围为5.0≤pH<6.7.第2步中加入适量NH4F溶液的作用是除去杂质Ca2+.
(5)将得到的草酸镍晶体在真空中加热至320℃分解可重新制得单质镍催化剂,写出该制备过程的化学方程式:NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O.
(6)已知废镍催化剂中镍的质量分数为5.9%,则100kg废镍催化剂最多可制得18.3kg草酸镍晶体(Ni:59,C:12,H:1,O:16).

已知:①Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9.
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |
(1)“粉碎”的目的是增大接触面积,加快反应速率,提高镍的浸出率.
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图2.“酸浸”的适宜温度与时间分别为c(填字母).
a.30℃、30min b.90℃、150min c.70℃、120min d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象 是静置,在上层清液中继续滴加(NH4)2C2O4溶液,若不产生沉淀,则Ni2+已经沉淀完全.将“沉镍”工序得到的混合物过滤,所得固体用75%乙醇溶液洗涤、110℃下烘干,得草酸镍晶体.用75%乙醇溶液洗涤的目的是洗去(NH4)2SO4杂质、便于烘干、减少草酸镍晶体损失.
(4)在除铁和铝工序中,应先加入H2O2氧化,再加氢氧化镍调节pH值的范围为5.0≤pH<6.7.第2步中加入适量NH4F溶液的作用是除去杂质Ca2+.
(5)将得到的草酸镍晶体在真空中加热至320℃分解可重新制得单质镍催化剂,写出该制备过程的化学方程式:NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O.
(6)已知废镍催化剂中镍的质量分数为5.9%,则100kg废镍催化剂最多可制得18.3kg草酸镍晶体(Ni:59,C:12,H:1,O:16).
13.铁及其化合物在日常生活、生产中应用广泛.研究铁及其化合物的应用意义重大.
I.水体的净化和污水的处理与铁及其化合物密切相关.
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理FeO42-有强的氧化性,能杀菌消毒,本身被还原为Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,达到净水的目的.
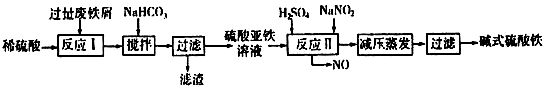
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
回答下列问题:
①写出反应I中发生的氧化还原反应的离子方程式Fe+2H+═Fe2++H2↑.
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为4.4~7.5.
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为69g.
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子.该水解反应的离子方程式为2[Fe(OH)]2++2H2O?[Fe2(OH)4]2++2H+;.
II.铁的化合物也是制备高能锂电池的重要原料.已知磷酸亚铁锂电池总反应为:
FePO4+Li$?_{充电}^{放电}$LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式LiFePO4-e-═FePO4+Li+.常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为14.(忽略溶液的体积变化).
I.水体的净化和污水的处理与铁及其化合物密切相关.
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理FeO42-有强的氧化性,能杀菌消毒,本身被还原为Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,达到净水的目的.
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
①写出反应I中发生的氧化还原反应的离子方程式Fe+2H+═Fe2++H2↑.
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为4.4~7.5.
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为69g.
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子.该水解反应的离子方程式为2[Fe(OH)]2++2H2O?[Fe2(OH)4]2++2H+;.
II.铁的化合物也是制备高能锂电池的重要原料.已知磷酸亚铁锂电池总反应为:
FePO4+Li$?_{充电}^{放电}$LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式LiFePO4-e-═FePO4+Li+.常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为14.(忽略溶液的体积变化).
20.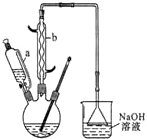 己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如图表:
己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如图表:
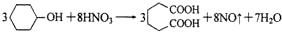
实验步骤如下:
Ⅰ.在三口烧瓶中加入16mL 50%的硝酸(密度为l.3lg/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇.
Ⅱ.水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间.
Ⅲ.当环己醇全部加入后,将混合物用80℃一90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止.
Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤、干燥、称重.
请回答下列问题:
(1)本实验所用50%的硝酸物质的量浓度为10.4 mol/L.滴液漏斗的细支管a的作用是平衡滴液漏斗与三口烧瓶内的气压,使环己醇能够顺利流下.
(2)仪器b的名称为球形冷凝管(或冷凝管).,使用时要从下口(填“上口”或“下口”)通入冷水.
(3)NaOH溶液的作用是吸收NO2,防止污染空气,溶液上方倒扣的漏斗作用是防止液体倒吸.
(4)向三口烧瓶中滴加环己醇时,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是将三口烧瓶置于冷水浴中.
(5)进行该实验时要控制好环己醇的滴入速率,防止反应过于剧烈,否则可能造成较严重的后果,试列举两条可能的后果:反应液暴沸冲出冷凝管;放热过多可能引起爆炸;产生的二氧化氮气体来不及被碱液吸收而外逸到空气中.
(6)为了除去可能的杂质和减少产品损失,可分别用冰水和苯洗涤晶体.
 己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如图表:
己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如图表:
| 物质 | 密度(g/cm3) | 熔点 | 沸点 | 溶解性 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
| 己二酸 | 1.360g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |
Ⅰ.在三口烧瓶中加入16mL 50%的硝酸(密度为l.3lg/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇.
Ⅱ.水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间.
Ⅲ.当环己醇全部加入后,将混合物用80℃一90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止.
Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤、干燥、称重.
请回答下列问题:
(1)本实验所用50%的硝酸物质的量浓度为10.4 mol/L.滴液漏斗的细支管a的作用是平衡滴液漏斗与三口烧瓶内的气压,使环己醇能够顺利流下.
(2)仪器b的名称为球形冷凝管(或冷凝管).,使用时要从下口(填“上口”或“下口”)通入冷水.
(3)NaOH溶液的作用是吸收NO2,防止污染空气,溶液上方倒扣的漏斗作用是防止液体倒吸.
(4)向三口烧瓶中滴加环己醇时,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是将三口烧瓶置于冷水浴中.
(5)进行该实验时要控制好环己醇的滴入速率,防止反应过于剧烈,否则可能造成较严重的后果,试列举两条可能的后果:反应液暴沸冲出冷凝管;放热过多可能引起爆炸;产生的二氧化氮气体来不及被碱液吸收而外逸到空气中.
(6)为了除去可能的杂质和减少产品损失,可分别用冰水和苯洗涤晶体.
18.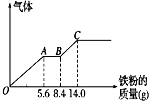 向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )
向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )
 向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )
向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )| A. | OA 段产生的是 NO,BC 段产生氢气,溶液中最终溶质为 FeSO4 | |
| B. | AB 段的反应为 Fe+2Fe3+═3Fe2+, | |
| C. | 原混合酸中NO3-物质的量为 0.3mol | |
| D. | H2SO4 浓度为 2.5 mol•L-1 |