题目内容
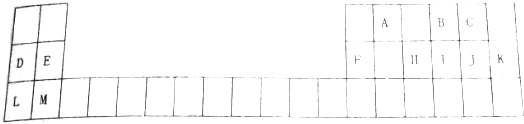
20.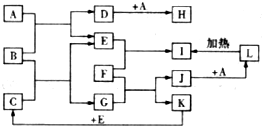 如图所示,各物质间存在如下相互转化关系,其中B为淡黄色固体.F为金属单质,能和氧化铁反应,生成铁单质.E和K为无色气体单质,其它物质均为化合物,A为无色气体,C为无色液体.
如图所示,各物质间存在如下相互转化关系,其中B为淡黄色固体.F为金属单质,能和氧化铁反应,生成铁单质.E和K为无色气体单质,其它物质均为化合物,A为无色气体,C为无色液体.试回答下列问题:
(1)H的化学式为NaHCO3,G的电子式为
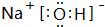 .
.(2)写出工业上制取单质F的化学方程式2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑.
(3)写出F与G反应的离子方程反应方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)D的水溶液显碱性,原因是CO32-+H2O?HCO3-+OH-(用离子方程式表示).
分析 B为淡黄色固体,B与无色气体A反应生成无色气体单质E,则B为Na2O2,A为CO2,E为O2,D为Na2CO3,H为NaHCO3.C为无色液体,与过氧化钠反应生成氧气与G,则C为H2O,G为NaOH,无色气体单质K与氧气生成水,则K为H2.F为金属单质,能和氧化铁反应,生成铁单质,F能与氢氧化钠溶液反应生成氢气,故F为Al,J为NaAlO2,I为Al2O3,L为Al(OH)3,据此解答.
解答 解:B为淡黄色固体,B与无色气体A反应生成无色气体单质E,则B为Na2O2,A为CO2,E为O2,D为Na2CO3,H为NaHCO3.C为无色液体,与过氧化钠反应生成氧气与G,则C为H2O,G为NaOH,无色气体单质K与氧气生成水,则K为H2.F为金属单质,能和氧化铁反应,生成铁单质,F能与氢氧化钠溶液反应生成氢气,故F为Al,J为NaAlO2,I为Al2O3,L为Al(OH)3.
(1)由上述分析可知,H为NaHCO3,G为NaOH,电子式为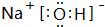 ,故答案为:NaHCO3;
,故答案为:NaHCO3;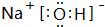 ;
;
(2)工业上电解熔融氧化铝冶炼Al,反应化学方程式为:2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,
故答案为:2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;
(3)铝与去氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)D为Na2CO3,溶液中CO32-离子发生水解:CO32-+H2O?HCO3-+OH-,破坏水的电离平衡,溶液呈碱性,
故答案为:碱;CO32-+H2O?HCO3-+OH-.
点评 本题考查无机物推断,B为淡黄色物质且反应生成气体单质为推断突破口,再结合转化关系推断,需要学生熟练掌握元素化合物性质,难度中等.

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案| A. | 常温常压下,20 g重甲基(-14CD3)所含的中子数为11NA | |
| B. | 常温常压下,22.4 L NO气体的分子数小于NA | |
| C. | 64 g铜发生氧化还原反应,一定失去2NA个电子 | |
| D. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
| A. | 同一种元素各核素的质量数不同,但它们的化学性质几乎完全相同 | |
| B. | 任何元素的原子都是由核外电子和核内质子、中子组成 | |
| C. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H互称为核素 | |
| D. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca、${\;}_{18}^{40}$Ar的质量数相同,所以它们是同位素 |
| A. | 正极附近c(H+)逐渐增大 | |
| B. | SO42-向正极移动 | |
| C. | 正极、负极附近c(H+)基本不变 | |
| D. | Zn片、Cu片同时冒出气泡,则说明Zn片不纯 |
| A. | 工业上生产环氧乙烷用乙烯为原料采用氯代乙醇法比石油化工银作催化剂氧化法原子利用率低 | |
| B. | 用二氧化氯或臭氧消毒的自来水比用氯气消毒的自来水卫生些 | |
| C. | 作为吸附剂和催化剂的人工分子筛是一种高分子有机化合物 | |
| D. | 原煤脱硫技术和煤液化气化工艺是防止我国近日中东部地区持续雾霾天气的有效措施之一 |
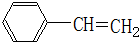 .
. .
.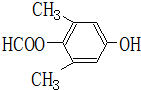 、
、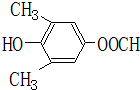 .
.