题目内容
8.将Zn和Cu用导线连接置于同一稀硫酸溶液中,下列叙述正确的是( )| A. | 正极附近c(H+)逐渐增大 | |
| B. | SO42-向正极移动 | |
| C. | 正极、负极附近c(H+)基本不变 | |
| D. | Zn片、Cu片同时冒出气泡,则说明Zn片不纯 |
分析 该装置构成原电池,锌易失电子作负极,铜作正极,正极上氢离子得电子发生还原反应,原电池放电时,阳离子向正极移动,阴离子向负极移动.
解答 解:A.该装置中,锌易失电子作负极,负极上锌失电子发生氧化反应生成锌离子,正极上氢离子得电子发生还原反应消耗氢离子,所以附近c(H+)逐渐减小,故A错误;
B.原电池放电时,阴离子向负极移动,所以SO42-向负极移动,故B错误;
C.原电池放电时,正极上氢离子得电子发生还原反应消耗氢离子,所以附近c(H+)逐渐减小,故C错误;
D.电子从锌片流向铜片,所以铜片上有大量电子,氢离子得电子生成氢气,所以氢气在铜片上析出;如果锌片上有氢气生成,则说明锌片不纯,锌与杂质电解质溶液形成原电池,故D正确;
故选D.
点评 本题考查了原电池原理,明确正负极上得失电子及电解质溶液中阴阳离子移动方向即可解答,难度不大.

练习册系列答案
相关题目
18.下列有关化学用语表示正确的是( )
| A. | CO2分子比例模型: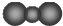 | B. | 硫离子的结构示意图为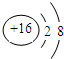 | ||
| C. | NH4Cl的电子式为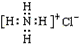 | D. | 中子数为20的氯原子${\;}_{17}^{37}$Cl |
16.下列反应的离子方程式正确的是( )
| A. | 次氯酸钙溶液中通入过量的二氧化碳Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| B. | 硫酸亚铁溶液中加入过氧化氢溶液Fe2++2H2O2+4H+═Fe3++4H2O | |
| C. | 用氨水吸收少量二氧化硫NH3•H2O+SO2═NH4++HSO3- | |
| D. | 硝酸铁溶液加入过量氨水3NH3•H2O+Fe3+═Fe(OH)3↓+3 NH4+ |
3.下列离子方程式错误的是( )
| A. | 钾和水反应:2K+2H2O=2K++2OH-+H2↑ | |
| B. | 氯化铝溶液加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| C. | 将Cl2通入氯化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 氢氧化钡溶液和硫酸铜溶液反应:Ba2++2OHˉ+Cu2++SO42ˉ=BaSO4↓+Cu(OH)2↓ |
12.下列实验操作或结论正确的是( )
| A. | 配制一定物质的量浓度的溶液时,将量取液态物质的量筒用水洗涤,洗涤液倒入容量瓶 | |
| B. | 用加热法可以分离KMnO4和碘单质的混合物 | |
| C. | 经氯气消毒的自来水,若用于配制Na2CO3溶液和FeSO4溶液均会使所配溶液变质 | |
| D. | 将金属钠在研钵中研成粉末,使钠与水反应的实验更安全 |
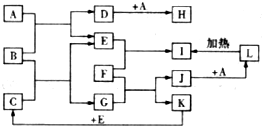 如图所示,各物质间存在如下相互转化关系,其中B为淡黄色固体.F为金属单质,能和氧化铁反应,生成铁单质.E和K为无色气体单质,其它物质均为化合物,A为无色气体,C为无色液体.
如图所示,各物质间存在如下相互转化关系,其中B为淡黄色固体.F为金属单质,能和氧化铁反应,生成铁单质.E和K为无色气体单质,其它物质均为化合物,A为无色气体,C为无色液体.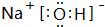 .
.