题目内容
15.下列说法不正确的是( )| A. | 工业上生产环氧乙烷用乙烯为原料采用氯代乙醇法比石油化工银作催化剂氧化法原子利用率低 | |
| B. | 用二氧化氯或臭氧消毒的自来水比用氯气消毒的自来水卫生些 | |
| C. | 作为吸附剂和催化剂的人工分子筛是一种高分子有机化合物 | |
| D. | 原煤脱硫技术和煤液化气化工艺是防止我国近日中东部地区持续雾霾天气的有效措施之一 |
分析 A、石油化工银作催化剂氧化法生产环氧乙烷,原子利用率百分之百;
B、二氧化氯和臭氧的消毒,无残留,而氯作为吸附剂和催化剂的人工分子筛是一种高分子有机化合物气的消毒,消毒水溶有氯气有毒,所以二氧化氯和臭氧逐步在推广,杀菌效果更快;
C、分子筛(又称合成沸石)是一种硅铝酸盐多微孔晶体;
D、原煤脱硫技术和煤液化气化工艺是防止产生粉尘污染,而粉尘污染是产生雾霾的主要污染物.
解答 解:A、石油化工银作催化剂氧化法生产环氧乙烷,原子利用率百分之百,所以用乙烯为原料采用氯代乙醇法比石油化工银作催化剂氧化法原子利用率低,故A正确;
B、二氧化氯和臭氧的消毒,无残留,而氯作为吸附剂和催化剂的人工分子筛是一种高分子有机化合物气的消毒,消毒水溶有氯气有毒,所以二氧化氯和臭氧逐步在推广,杀菌效果更快,故B正确;
C、分子筛(又称合成沸石)是一种硅铝酸盐多微孔晶体,不是高分子有机化合物,故C错误;
D、原煤脱硫技术和煤液化气化工艺是防止产生粉尘污染,而粉尘污染是产生雾霾的主要污染物,所以原煤脱硫技术和煤液化气化工艺是防止我国近日中东部地区持续雾霾天气的有效措施之一,故D正确;
故选C.
点评 本题考查环境污染,为高频考点,侧重于化学与生活、环境的考查,有利于培养学习的良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
相关题目
5.下表列出了A~R九种元素在周期表中的位置,请按要求回答下列问题:
(1)已知A是短周期中金属性最强的元素,则A、C、G、F四种元素按离子半径由大到小的顺序排列为r(Cl-)>r(F-)>r(Na+)>r(Mg2+);(用“微粒符号”填空)
(2)这九种元素的最高价氧化物对应的水化物中,酸性最强的是HClO4、碱性最强的是KOH;(用“化学式”填空)
(3)F、G、H三种元素对应氢化物中沸点最高的是HF,原因是HF分子间既有范德华力也存在氢键而氯化氢、溴化氢的分子间只有范德华力没有氢键,氢键是一种比范德华力要稍强的作用;
(4)实验室检验B元素需要用到的特殊用品为蓝色钴玻璃;
(5)请用电子式表示化合物CF2的形成过程 .
.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| E | F | ||||||
| A | C | D | G | R | |||
| B | H |
(2)这九种元素的最高价氧化物对应的水化物中,酸性最强的是HClO4、碱性最强的是KOH;(用“化学式”填空)
(3)F、G、H三种元素对应氢化物中沸点最高的是HF,原因是HF分子间既有范德华力也存在氢键而氯化氢、溴化氢的分子间只有范德华力没有氢键,氢键是一种比范德华力要稍强的作用;
(4)实验室检验B元素需要用到的特殊用品为蓝色钴玻璃;
(5)请用电子式表示化合物CF2的形成过程
 .
.
3.下列离子方程式错误的是( )
| A. | 钾和水反应:2K+2H2O=2K++2OH-+H2↑ | |
| B. | 氯化铝溶液加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| C. | 将Cl2通入氯化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 氢氧化钡溶液和硫酸铜溶液反应:Ba2++2OHˉ+Cu2++SO42ˉ=BaSO4↓+Cu(OH)2↓ |
10.阳离子X2+含中子N个,X的质量数为A,则a g X的同价氧化物中含质子的物质的量是( )
| A. | $\frac{a}{N}$(N-a)mol | B. | $\frac{a}{A+16}$(A-N+10)mol | C. | $\frac{a}{A+8}$(N+n)mol | D. | $\frac{a}{A+16}$(A-N+8)mol |
7.设NA为阿伏伽德罗常数的数值,下列说法中正确的是( )
| A. | 16g的CH4中含有4NA个C-H键 | |
| B. | 1mol•L-1 NaCl溶液中含有NA个Na+ | |
| C. | 常温常压下,22.4L CO2中含有NA个CO2分子 | |
| D. | 标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA |
4.下列各组实验中最先变浑浊的是(Na2S2O3和H2SO4混合会产生浑浊现象)( )
| A. | 0.1 mol•L-1Na2S2O3和H2SO4各5mL,加水5mL,反应温度10℃ | |
| B. | 0.1 mol•L-1Na2S2O3和H2SO4各5mL,加水10mL,反应温度10℃ | |
| C. | 0.1 mol•L-1Na2S2O3和H2SO4各5mL,加水10mL,反应温度30℃ | |
| D. | 0.2 mol•L-1Na2S2O3和H2SO4各5mL,加水10mL,反应温度30℃ |
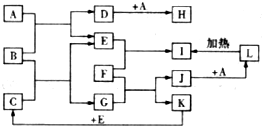 如图所示,各物质间存在如下相互转化关系,其中B为淡黄色固体.F为金属单质,能和氧化铁反应,生成铁单质.E和K为无色气体单质,其它物质均为化合物,A为无色气体,C为无色液体.
如图所示,各物质间存在如下相互转化关系,其中B为淡黄色固体.F为金属单质,能和氧化铁反应,生成铁单质.E和K为无色气体单质,其它物质均为化合物,A为无色气体,C为无色液体.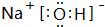 .
.
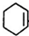 +Br2→
+Br2→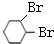 .
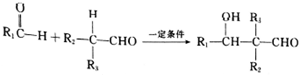
.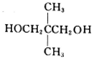 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$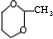 或
或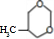 .
.