题目内容
12.表是元素周期表的一部分元素,回答下列问题: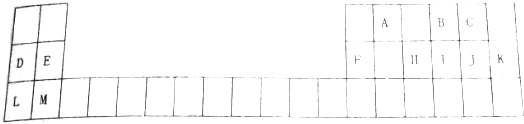
(1)表中用字母标出的12元素中,化学性质最不活泼的Ar(用元素符号表示,下同),金属性最强的是K,非金属性最强的是F.
(2)H、I、J氢化物中以PH3最不稳定(填化学式)
(3)除稀有气体外第三周期中原子半径最小的是Cl(填元素符号)
(4)写出H、J素最高价氧化物的对应水化物的化学式:H3PO4和HClO4.
(5)D与F最高价氧化物对应水化物相互反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
分析 根据元素在周期表中的位置知,从A到M分别是C、O、F、Na、Mg、Al、P、S、Cl、Ar、K、Ca元素,
(1)表中用字母标出的12元素中,化学性质最不活泼的是稀有气体,金属性最强的元素位于周期表左下角,非金属性最强的元素位于周期表右上角但稀有气体除外;
(2)元素的非金属性越强,其氢化物越稳定;
(3)除了稀有气体外,同一周期元素,原子半径随着原子序数增大而减小;
(4)H、J素最高价氧化物的对应水化物分别是磷酸、高氯酸;
(5)D与F最高价氧化物对应水化物分别是NaOH、Al(OH)3,二者反应生成偏铝酸钠和水.
解答 解:根据元素在周期表中的位置知,从A到M分别是C、O、F、Na、Mg、Al、P、S、Cl、Ar、K、Ca元素,
(1)表中用字母标出的12元素中,化学性质最不活泼的是稀有气体,所以是Ar;金属性最强的元素位于周期表左下角,为K元素;非金属性最强的元素位于周期表右上角但稀有气体除外,为F元素,
故答案为:Ar;K;F;
(2)元素的非金属性越强,其氢化物越稳定,这三种元素非金属性强弱顺序是Cl>S>P,所以氢化物最不稳定的是PH3,故答案为:PH3;
(3)除了稀有气体外,同一周期元素,原子半径随着原子序数增大而减小,所以第三周期原子半径最小的是Cl元素,故答案为:Cl;
(4)H、J素最高价氧化物的对应水化物分别是磷酸、高氯酸,分子式分别为H3PO4、HClO4,故答案为:H3PO4;HClO4;
(5)D与F最高价氧化物对应水化物分别是NaOH、Al(OH)3,二者反应生成偏铝酸钠和水,离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查元素周期表和元素周期律的综合应用,为高频考点,涉及元素周期律、离子反应等知识点,熟悉元素周期律内涵是解本题关键,知道金属性、非金属性强弱判断方法,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 医用酒精 | B. | 生理盐水 | C. | 碘酒 | D. | 冰水混合物 |
| A. | 钾和水反应:2K+2H2O=2K++2OH-+H2↑ | |
| B. | 氯化铝溶液加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| C. | 将Cl2通入氯化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 氢氧化钡溶液和硫酸铜溶液反应:Ba2++2OHˉ+Cu2++SO42ˉ=BaSO4↓+Cu(OH)2↓ |
| A. | 16g的CH4中含有4NA个C-H键 | |
| B. | 1mol•L-1 NaCl溶液中含有NA个Na+ | |
| C. | 常温常压下,22.4L CO2中含有NA个CO2分子 | |
| D. | 标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA |
| A. | 0.1 mol•L-1Na2S2O3和H2SO4各5mL,加水5mL,反应温度10℃ | |
| B. | 0.1 mol•L-1Na2S2O3和H2SO4各5mL,加水10mL,反应温度10℃ | |
| C. | 0.1 mol•L-1Na2S2O3和H2SO4各5mL,加水10mL,反应温度30℃ | |
| D. | 0.2 mol•L-1Na2S2O3和H2SO4各5mL,加水10mL,反应温度30℃ |
| A. | 分子的立体结构为正四面体 | B. | 碳原子以sp3杂化 | ||
| C. | 属于极性分子 | D. | 有手性异构体 |
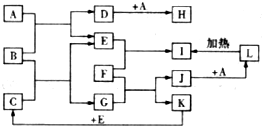 如图所示,各物质间存在如下相互转化关系,其中B为淡黄色固体.F为金属单质,能和氧化铁反应,生成铁单质.E和K为无色气体单质,其它物质均为化合物,A为无色气体,C为无色液体.
如图所示,各物质间存在如下相互转化关系,其中B为淡黄色固体.F为金属单质,能和氧化铁反应,生成铁单质.E和K为无色气体单质,其它物质均为化合物,A为无色气体,C为无色液体.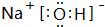 .
.