题目内容
10.设NA代表阿伏加德罗常数的数值,下列说法中不正确的是( )| A. | 常温常压下,20 g重甲基(-14CD3)所含的中子数为11NA | |
| B. | 常温常压下,22.4 L NO气体的分子数小于NA | |
| C. | 64 g铜发生氧化还原反应,一定失去2NA个电子 | |
| D. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
分析 A、重甲基(-14CD3)中含有11个中子,摩尔质量为20g/mol;
B、常温常压下,气体摩尔体积大于22.4L/mol,所以22.4L NO气体的物质的量小于1mol;
C、64g铜发生氧化还原反应,若与硫单质反应生成的是硫化亚铁;1mol铜失去1mol电子;
D、21.0g乙烯和丁烯的最简式为CH2,根据二者的最简式计算出混合气体中含有的碳原子数目;
解答 解:A、常温常压下,20g重甲基(-14CD3)的物质的量为1mol,含有11mol中子,所含的中子数为11NA,故A不符合;
B、常温常压下,气体摩尔体积大于22.4L/mol,则22.4L NO气体的物质的量小于1mol,含有的分子数小于NA,故B不符合;
C、64g铜的物质的量为1mol,1mol铜与硫单质反应生成0.5mol硫化亚铜,转移了1mol单质,转移了NA个电子,故C符合;
D、室温下,21.0g乙烯和丁烯的混合气体中含有1.5mol最简式CH2,含有1.5mol碳原子,含有的碳原子数目为1.5NA,故D不符合;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,试题题量较大,知识点较多,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
20.1828年,填平无机物与有机物间鸿沟的科学巨匠乌勒将一种无机盐直接转变为有机物尿素[CO(NH2)2],乌勒使用的无机盐是( )
| A. | NH4NO3 | B. | (NH4)2CO3 | C. | NH4CNO | D. | CH3COONH4 |
18.下列有关化学用语表示正确的是( )
| A. | CO2分子比例模型: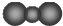 | B. | 硫离子的结构示意图为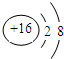 | ||
| C. | NH4Cl的电子式为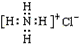 | D. | 中子数为20的氯原子${\;}_{17}^{37}$Cl |
5.下表列出了A~R九种元素在周期表中的位置,请按要求回答下列问题:
(1)已知A是短周期中金属性最强的元素,则A、C、G、F四种元素按离子半径由大到小的顺序排列为r(Cl-)>r(F-)>r(Na+)>r(Mg2+);(用“微粒符号”填空)
(2)这九种元素的最高价氧化物对应的水化物中,酸性最强的是HClO4、碱性最强的是KOH;(用“化学式”填空)
(3)F、G、H三种元素对应氢化物中沸点最高的是HF,原因是HF分子间既有范德华力也存在氢键而氯化氢、溴化氢的分子间只有范德华力没有氢键,氢键是一种比范德华力要稍强的作用;
(4)实验室检验B元素需要用到的特殊用品为蓝色钴玻璃;
(5)请用电子式表示化合物CF2的形成过程 .
.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| E | F | ||||||
| A | C | D | G | R | |||
| B | H |
(2)这九种元素的最高价氧化物对应的水化物中,酸性最强的是HClO4、碱性最强的是KOH;(用“化学式”填空)
(3)F、G、H三种元素对应氢化物中沸点最高的是HF,原因是HF分子间既有范德华力也存在氢键而氯化氢、溴化氢的分子间只有范德华力没有氢键,氢键是一种比范德华力要稍强的作用;
(4)实验室检验B元素需要用到的特殊用品为蓝色钴玻璃;
(5)请用电子式表示化合物CF2的形成过程
 .
.
15.下列物质中,只含有离子键的是( )
| A. | NaOH | B. | H2 | C. | NaCl | D. | H2S |
2.下列物质中属于纯净物的是( )
| A. | 医用酒精 | B. | 生理盐水 | C. | 碘酒 | D. | 冰水混合物 |
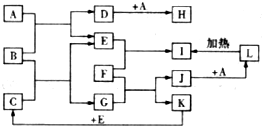 如图所示,各物质间存在如下相互转化关系,其中B为淡黄色固体.F为金属单质,能和氧化铁反应,生成铁单质.E和K为无色气体单质,其它物质均为化合物,A为无色气体,C为无色液体.
如图所示,各物质间存在如下相互转化关系,其中B为淡黄色固体.F为金属单质,能和氧化铁反应,生成铁单质.E和K为无色气体单质,其它物质均为化合物,A为无色气体,C为无色液体.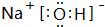 .
.