题目内容
9.某化学反应中,设反应物的总能量为E1,生成物的总能量为E2.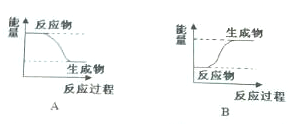
(1)若E1>E2,则该反应为放热(填“放热”或“吸热”)反应,该反应可用图A(填“A”或“B”)表示.
(2)从手册上查得:H-H键,Cl-Cl键和H-Cl键的键能分别为436kJ/mol、243kJ/mol、431kJ/mol,请用此数据估计,由Cl2和H2反应生成2mol HCl时的反应热是-183KJ/mol.
(3)现有如下两个反应:①NaOH+HCl=NaCl+H2O,②Fe+H2SO4=FeSO4+H2↑.两反应中为放热反应的是①②,能设计成原电池的是②.
分析 (1)根据反应物的总能量为E1和生成物的总能量为E2的相对大小判断;
(2)反应方程式为:H2+Cl2=2HCl,根据吸收的能量之和与放出的能量之和的相对大小判断反应的吸放热,二者的差值即为焓变的数值;
(3)酸碱中和反应和活泼金属与酸的反应都是放热反应;要构成原电池必须能自发的氧化还原反应.
解答 解:(1)若反应物的总能量为E1大于生成物的总能量为E2,则为放热反应,故答案为:放热;A;
(2)反应方程式为:H2+Cl2=2HCl,生成2molHCl,需吸收能量:436kJ+243kJ=679kJ,放出能量:2×431kJ=862kJ,放出的能量大于吸收的能量,则该反应放热,焓变为负号,且放出的热量为:862kJ-679kJ=183kJ,所以△H=-183KJ/mol.
故答案为:-183KJ/mol;
(3)酸碱中和反应和活泼金属与酸的反应都是放热反应,所以①②都是放热反应;要构成原电池必须能自发的氧化还原反应,NaOH+HCl=NaCl+H2O是非氧化还原反应,而Fe+H2SO4=FeSO4+H2↑是氧化还原反应,故答案为:①②;②.
点评 本题考查反应中的能量变化的原因、反应热的计算以及原电池原理,题目难度不大.

练习册系列答案
相关题目
4.下列各组实验中最先变浑浊的是(Na2S2O3和H2SO4混合会产生浑浊现象)( )
| A. | 0.1 mol•L-1Na2S2O3和H2SO4各5mL,加水5mL,反应温度10℃ | |
| B. | 0.1 mol•L-1Na2S2O3和H2SO4各5mL,加水10mL,反应温度10℃ | |
| C. | 0.1 mol•L-1Na2S2O3和H2SO4各5mL,加水10mL,反应温度30℃ | |
| D. | 0.2 mol•L-1Na2S2O3和H2SO4各5mL,加水10mL,反应温度30℃ |
14.下列实验方案中,能测定Na2CO3和NaCl混合物中NaCl质量分数的是( )
| A. | 取a克混合物与足量浓盐酸充分反应,通过排饱和NaHCO3溶液测得生成气体b升(标准状况) | |
| B. | 取a克混合物与足量硝酸银溶液充分反应,过滤、洗涤、烘干,得b克固体 | |
| C. | 取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 | |
| D. | 取a克混合物与足量Ba(OH)2溶液充分反应,过滤,称量得b克固体 |
1.理论上存在的氟氯溴碘甲烷(CFClBrI)极难合成,下列有关CFClBrI的说法不正确的是( )
| A. | 分子的立体结构为正四面体 | B. | 碳原子以sp3杂化 | ||
| C. | 属于极性分子 | D. | 有手性异构体 |
12.下列实验操作或结论正确的是( )
| A. | 配制一定物质的量浓度的溶液时,将量取液态物质的量筒用水洗涤,洗涤液倒入容量瓶 | |
| B. | 用加热法可以分离KMnO4和碘单质的混合物 | |
| C. | 经氯气消毒的自来水,若用于配制Na2CO3溶液和FeSO4溶液均会使所配溶液变质 | |
| D. | 将金属钠在研钵中研成粉末,使钠与水反应的实验更安全 |
13.下列表达方式正确的是( )
| A. | 碳-12原子:${\;}_{12}^{6}$C | B. | 硫离子结构示意图: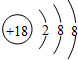 | ||
| C. | 氢氧根的电子式: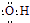 | D. | HClO的结构式:H-O-Cl |
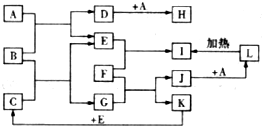 如图所示,各物质间存在如下相互转化关系,其中B为淡黄色固体.F为金属单质,能和氧化铁反应,生成铁单质.E和K为无色气体单质,其它物质均为化合物,A为无色气体,C为无色液体.
如图所示,各物质间存在如下相互转化关系,其中B为淡黄色固体.F为金属单质,能和氧化铁反应,生成铁单质.E和K为无色气体单质,其它物质均为化合物,A为无色气体,C为无色液体.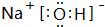 .
.