题目内容
9. 有关元素X、Y、Z、D、E的信息如表
有关元素X、Y、Z、D、E的信息如表| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物既能溶于强酸又能溶于强碱 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)E在元素周期表中的位置为第四周期第Ⅷ族;Z的氢化物电子式为

(2)X、Y、D形成的简单离子的半径由大到小为Cl->O2->Al3+.
(3)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,D的最高价氧化物溶于强碱的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(4)E元素与Y元素可形成EY2和 EY3两种化合物,下列说法正确的是(填序号)①②③.
①保存EY2溶液时,需向溶液加入少量E单质
②EY2、EY3均能通过化合反应生成
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④向煮沸的NaOH溶液中滴加几滴饱和EY3溶液,可以制得胶体
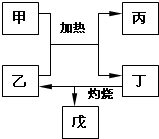
(5)如图所示物质均为常见化合物,其中甲为上述五种元素中的两种组成,乙在常温下为液态,工业上常用电解戊冶炼金属,则甲与乙发生反应的化学方程式AlCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3+3HCl↑.
分析 X元素主要化合价为-2,原子半径为0.074nm,则X处于第ⅥA族;
Z原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰,则Z为S元素,X为O元素;
D最高价氧化物既能溶于强酸又能溶于强碱,则D为Al元素;
E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏,则E为Fe元素;
Y所在主族序数与所在周期序数之差为4,满足该条件元素为O或Cl,由于X为O元素,则Y为Cl元素,
甲为上述五种元素中的两种组成,乙在常温下为液态,则乙为水,工业上常用电解戊冶炼金属,戊为氧化铝,所以丁为氢氧化铝,故甲为铝盐,故为氯化铝,据此答题;
解答 解:X元素主要化合价为-2,原子半径为0.074nm,则X处于第ⅥA族;Z原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰,则Z为S元素,X为O元素;D最高价氧化物既能溶于强酸又能溶于强碱,则D为Al元素;
E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏,则E为Fe元素;Y所在主族序数与所在周期序数之差为4,满足该条件元素为O或Cl,由于X为O元素,则Y为Cl元素.
即X为O元素,Y为Cl元素,Z为S元素,D为Al元素,E为Fe元素.
(1)E为Fe元素,处于元素周期表第四周期第Ⅷ族;Z为S元素,氢化物为H2S,属于共价化合物,硫原子与氢原子之间形成1对共用电子对,电子式为 .
.
故答案为:第四周期第Ⅷ族; ;
;
(2)X、Y、D形成的简单离子分别为O2-、Cl-、Al3+.O2-、Al3+离子的核外电子排布相同,核电荷数越大,离子半径越小,所以离子半径O2->Al3+,Cl-、O2-的最外层电子数相同,电子层越多,离子半径越大,所以离子半径Cl->O2-,所以离子半径Cl->O2->Al3+.
故答案为:Cl->O2->Al3+;
(3)X为O元素,X的一种氢化物可用于实验室制取X的单质,则为过氧化氢分解制取氧气,反应方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;D的最高价氧化物为Al2O3,溶于强碱生成偏铝酸根离子和水,离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;Al2O3+2OH-=2AlO2-+H2O;
(4)E元素与Y元素可形成EY2和 EY3两种化合物为FeCl2、FeCl3,
①FeCl2易被氧气氧化,保存FeCl2溶液时,需向溶液加入少量Fe单质,故①正确;
②FeCl2可通过FeCl3与Fe化合得到,FeCl3可由铁与氯气化合得到,故②正确;
③铜片、碳棒和FeCl3溶液组成原电池,铜发生氧化反应,为负极,电子由铜片沿导线流向碳棒,故③正确;
④向煮沸的NaOH溶液中滴加几滴饱和FeCl3溶液,得到氢氧化铁沉淀,不能得到氢氧化铁胶体,故④错误,
故选:①②③.
(5)甲为上述五种元素中的两种组成,乙在常温下为液态,则乙为水,工业上常用电解戊冶炼金属,戊为氧化铝,所以丁为氢氧化铝,故甲为铝盐,故为氯化铝.则甲与乙发生反应的化学方程式 AlCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3+3HCl↑;
故答案为:AlCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3+3HCl↑.
点评 以元素推断为载体,考查化学用语、半径比较、元素化合物性质等,综合性较大,难度中等,是对所学知识的综合性考查,注意基础知识的理解掌握.推断元素是解题关键.

| A. | X2Y3 | B. | XY3 | C. | X2Y4 | D. | X3Y |
| A. | Cd(OH)2 | B. | Ni(OH)2 | C. | NiO(OH) | D. | Cd |
| A. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 | |
| B. | 原子弹爆炸是放热反应 | |
| C. | 若C(石墨,s)=C(金刚石,s)△H>0,则石墨能量低且键能小 | |
| D. | 由BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ•mol-1①BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1 ②可得反应C(s)+CO2(g)=2CO(g) 的△H=+172.5kJ•mol-1 |
| A. | 方框中的物质应为 Cu2S | |
| B. | 若有1 molSO2生成,则反应中有4 mol 电子转移 | |
| C. | SO2既是氧化产物又是还原产物 | |
| D. | O2只作氧化剂 |
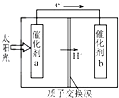 人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.如图是通过人工光合作用制备HCOOH的原理示意图,下列说法正确的是( )
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.如图是通过人工光合作用制备HCOOH的原理示意图,下列说法正确的是( )| A. | 该过程可以实现太阳能与电能的直接转换 | |
| B. | 催化剂a表面发生氧化反应,有O2产生 | |
| C. | 催化剂b附近酸性增强,催化剂a附近酸性减弱 | |
| D. | 催化剂a表面的反应是CO2+2H++2e-═HCOOH |
| 主要成分:25% NaClO、1000mL、密度1.198g•cm-3 使用方法:稀释100倍(体积比)后使用 注意事项:密封保存,易吸收空气中CO2的变质 |
| A. | 该“84消毒液”的浓度为4.0mol•L-1 | |
| B. | 一瓶该“84消毒液”可能吸收CO2 44.8L(标况) | |
| C. | 稀释后的“84消毒液”中c(Na+)约为0.04 mol•L-1 | |
| D. | 若用NaClO 固体配制480mL含25%NaClO“84消毒液”,需要称量NaClO固体143g |
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 102 | 74 |
| 主要化合价 | +2 | +3 | +6、+4、-2 | -2 |
| A. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| B. | X和Y的金属性X<Y | |
| C. | 气态氰化物的稳定性H2Z<H2W | |
| D. | ZW3通常用单质Z与单质W反应制备 |