题目内容
14.某温度T1时,向容积为2L的恒容密闭容器中充入一定量的H2和I2(g),发生反应:H2(g)+I2(g)?2HI(g)反应过程中测定的部分数据见下表(表中t2>t1):下列说法正确的是( )| 反应时间/min | n(H2)/mol | n(I2)/mol |
| 0 | 0.9 | 0.3 |
| t1 | 0.8 | |
| t2 | 0.2 |
| A. | 反应在t1 min内的平均速率为:v(H2)=$\frac{0.1}{{t}_{1}}$mol•L-1•min-1 | |
| B. | 保持其他条件不变,向平衡体系中再通入0.20 mol H2,与原平衡相比,达到新平衡时I2(g)转化率增大,H2的体积分数不变 | |
| C. | 保持其他条件不变,起始时向容器中充入的H2和I2(g)都为0.5mol,达到平衡时n(HI)=0.2 mol | |
| D. | 升高温度至T2时,上述反应平衡常数为0.18,则正反应为吸热反应 |
分析 A.根据v=$\frac{△c}{△t}$进行计算;
B.恒温恒压,增加一种反应物浓度可以提高另一种反应物的转化率,自身的体积分数增大;
C.平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,结合平衡三段式计算平衡常数,再根据平衡常数计算平衡时HI的物质的量;
D.平衡常数减小,平衡逆向移动,依此进行判断.
解答 解:A.由表中数据可知,t1min内参加反应的H2的物质的量为0.9mol-0.8mol=0.1mol,故v(H2)=$\frac{\frac{0.1mol}{2L}}{{t}_{1}min}$=$\frac{0.05}{{t}_{1}}$mol/(L•min),故A错误;
B.保持其他条件不变,向平衡体系中再通入0.20 mol H2,与原平衡相比,H2的体积分数增大;H2的浓度增大,平衡正向移动,故I2(g)转化率增大,故B错误;
C.t1时,H2(g)+I2(g)?2HI(g)
起始 0.9 0.3
转化 0.1 0.1 0.2
平衡 0.8 0.2 0.2
平衡常数K=$\frac{{c}^{2}(HI)}{c({H}_{2})•c({I}_{2})}$=$\frac{\frac{0.2}{2}×\frac{0.2}{2}}{\frac{0.8}{2}×\frac{0.2}{2}}$=0.25,
t2时,H2(g)+I2(g)?2HI(g)
起始 0.5 0.5
转化 x x 2x
平衡 0.5-x 0.5-x 2x
K=$\frac{\frac{2x}{2}×\frac{2x}{2}}{\frac{0.5-x}{2}×\frac{0.5-x}{2}}$=0.25,解得x=0.1mol,故平衡时n(HI)=0.1mol×2=0.2mol,故C正确;
D.升高温度至T2时,上述反应平衡常数为0.18<0.25,说明升高温度,平衡逆向移动,故正反应为放热反应,故D错误;
故选C.
点评 本题主要考查化学反应速率的计算、化学平衡常数的计算、影响平衡移动的因素等知识点,难度中等.要注意平衡常数的灵活运用.

| A. | 硅胶作干燥剂是利用其多孔、吸附水分的能力强 | |
| B. | 铝在空气中必须出良好的抗腐蚀性,说明铝极难与氧气反应 | |
| C. | 明矾可用于饮水的消毒杀菌 | |
| D. | 光导纤维比普通电缆有更强的传输信息能力,是因为其导电能力强 |
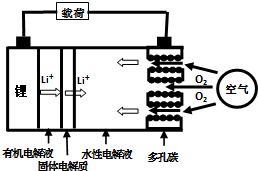 金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作示意图如下,下列说法正确的是( )
金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作示意图如下,下列说法正确的是( )| A. | 放电时,空气极为负极 | |
| B. | 放电时,电池反应为:4Li+O2=2Li2O | |
| C. | 有机电解液可以是乙醇等无水有机物 | |
| D. | 在更换锂电极的同时,要更换水性电解液 |
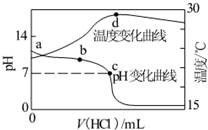 室温下,向20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,向20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | 氨水的电离程度a>b>c | |
| B. | a、d两点的溶液,水的离子积Kw(a)>Kw(d) | |
| C. | c点时消耗盐酸体积V(HCl)<20.00mL | |
| D. | d点时溶液温度达到最高,之后温度略有下降,原因是NH3•H2O电离吸热 |
| A. | 钛属于主族元素 | |
| B. | 钛合金强度很大 | |
| C. | 蒸干TiCl4溶液可得无水钛盐 | |
| D. | 在空气中将金属钛、铝混合后熔化可制得合金 |
| A. | 鸡蛋清溶液中加入醋酸铅溶液,会发生盐析 | |
| B. | 青苹果中富含苹果酸,因此苹果是酸性食物 | |
| C. | 过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源 | |
| D. | 氢氧化钠、碳酸钙、氢氧化铝等可作为抗酸药 |
| A. | 用海水制盐 | B. | 从海水中提取镁 | C. | 从海水中提取溴 | D. | 从海带中提取碘 |
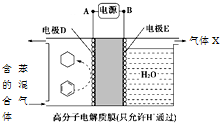
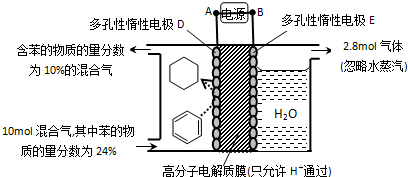
| A. | A为电源的正极 | |
| B. | 气体X是H2 | |
| C. | 电极E为阴极 | |
| D. | 电极D的电极反应式为C6H6+6H++6e-=C6H12 |
 (g)$\stackrel{催化剂}{?}$
(g)$\stackrel{催化剂}{?}$ (g)+3H2(g)△H
(g)+3H2(g)△H