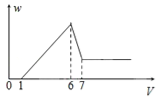
题目内容
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.31g白磷晶体中含有P-P键数是NA
B.22.4LSO2含有NA个SO2分子
C.标准状况下,等质量的NO2和N2O4所含有原子个数相等
D.1molCl2通入热的NaOH溶液中(产物是NaCl、NaClO3),充分反应后转移的电子数为NA个
【答案】C
【解析】
A. 31g白磷的物质的量是![]() 0.25mol,1个白磷分子中有6个P-P键,31g白磷晶体中含有P-P键数是0.25×6×NA=1.5 NA,故A错误;
0.25mol,1个白磷分子中有6个P-P键,31g白磷晶体中含有P-P键数是0.25×6×NA=1.5 NA,故A错误;
B. 非标准状况下,22.4LSO2的物质的量不一定是1mol,故B错误;
C. NO2和N2O4的最简式相同,所以等质量的NO2和N2O4所含有原子个数相等,故C正确;
D. Cl2通入热的NaOH溶液中(产物是NaCl、NaClO3),反应方程式是3Cl2+6NaOH=5NaCl+NaClO3+3H2O,部分氯元素化合价由0升高为+5,部分氯元素化合价由0降低为-1,3mol氯气转移5mol电子,1mol氯气充分反应后转移的电子数为![]() NA个,故D错误。
NA个,故D错误。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】卤素的单质和化合物种类很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。回答下列问题:
(1)溴原子的价层电子排布图为_______。根据下表提供的第一电离能数据,判断最有可能生成较稳定的单核阳离子的卤素原子是________(填元素符号)。
氟 | 氯 | 溴 | 碘 | |
第一电离能/ (kJ·mol-1) | 1 681 | 1 251 | 1 140 | 1 008 |
(2)氢氟酸在一定浓度的溶液中主要以二分子缔合[(HF)2]形式存在,使氟化氢分子缔合的相互作用是____________。碘在水中溶解度小,但在碘化钾溶液中明显增大,这是由于发生反应:I-+I2=I3-,CsICl2与KI3类似,受热易分解,倾向于生成晶格能更大的物质,试写出CsICl2受热分解的化学方程式:_________________________________。
(3)ClO2-中心氯原子的杂化轨道类型为________,与ClO2-具有相同立体构型和键合形式的物质的化学式为____________(写出一个即可)。
(4)如图甲为碘晶体晶胞结构,平均每个晶胞中有________个碘原子,碘晶体中碘分子的配位数为____________。


(5)已知NA为阿伏加德罗常数,CaF2晶体密度为ρ g·cm-3,其晶胞如图乙所示,两个最近Ca2+核间距离为a nm,则CaF2的相对分子质量可以表示为____________。