题目内容
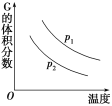
【题目】密闭容器中有如下反应:L(s)+aG(g) ![]() bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )
bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )
A.正反应为放热反应
B.G的转化率随温度升高而减小
C.化学方程式中的计量数a>b
D.增大压强,容器内气体质量不变
【答案】C
【解析】
根据图象可知,升高温度,G的体积分数减小,平衡正向移动,正反应为吸热反应;从P1到P2作等温线,增大压强,G的体积分数减小,平衡正向移动,a>b;
A.由分析可知,正反应为吸热反应,A错误;
B.由图象可知,G的体积分数随温度的升高而降低,G的转化率增大,B错误;
C.由分析可知,化学方程式中的计量数a>b,C正确;
D.增大压强,体积减小,平衡正向移动,容器内气体质量增大,D错误;
答案为C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】中国传统文化中包括许多科技知识。下列古语中不涉及化学变化的是
千淘万漉虽辛苦,吹尽狂沙始到金 |
熬胆矾(CuSO4·5H2O) 铁釜,久之亦化为铜 |
凡石灰(CaCO3), 经火焚炼为用 |
丹砂(HgS)烧之成水银,积变又成丹砂 |
A | B | C | D |
A. A B. B C. C D. D
【题目】通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
化学键 | H—H | Cl—Cl | H—Cl |
生成1 mol化学键时放出的能量 | 436 kJ/mol | 243 kJ/mol | 431 kJ/mol |
则下列热化学方程式不正确的是 ( )
A.1/2H2(g)+1/2Cl2(g)===HCl(g)ΔH=-91.5 kJ/mol
B.H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ/mol
C.2HCl(g)===H2(g)+Cl2(g) ΔH=+183 kJ/mol
D.1/2H2(g)+1/2Cl2(g)===HCl(g)ΔH=+91.5 kJ/mol




