题目内容
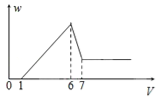
【题目】使一镁铝合金粉末在过量稀H2SO4中溶解,在所得溶液中加入NaOH溶液,生成沉淀的质量w和加入NaOH溶液的体积V的关系如图所示,则该合金中镁和铝的质量之比为( )
A. 2:3 B. 1:1 C. 4:3 D. 8:9
【答案】D
【解析】试题分析:生成沉淀与沉淀溶解两阶段消耗NaOH体积之比为(6﹣1):(7﹣6)=5:1,假设溶解氢氧化铝消耗NaOH为1mol,则生成沉淀消耗NaOH为5mol,根据Al(OH)3+NaOH=NaAlO2+2H2O,计算氢氧化铝物质的量,再根据生成沉淀消耗NaOH计算氢氧化镁物质的量,根据元素守恒计算Mg、Al质量之比.
解:生成沉淀与沉淀溶解两阶段消耗NaOH体积之比为(6﹣1):(7﹣6)=5:1,假设溶解氢氧化铝消耗NaOH为1mol,则生成沉淀消耗NaOH为5mol,
Al(OH)3+NaOH=NaAlO2+2H2O
1mol 1mol
由Al元素守恒,可知m(Al)=1mol×27g/mol=27g,
生成1mol氢氧化铝消耗NaOH为1mol×3=3mol,则生成氢氧化镁消耗NaOH为5mol﹣3mol=2mol,则氢氧化镁为1mol,由Mg元素守恒,则m(Mg)=1mol×24g/mol=24g,
故该合金中镁和铝的质量之比为24g:27g=8:9,
故选D.

【题目】中国传统文化中包括许多科技知识。下列古语中不涉及化学变化的是
千淘万漉虽辛苦,吹尽狂沙始到金 |
熬胆矾(CuSO4·5H2O) 铁釜,久之亦化为铜 |
凡石灰(CaCO3), 经火焚炼为用 |
丹砂(HgS)烧之成水银,积变又成丹砂 |
A | B | C | D |
A. A B. B C. C D. D
【题目】通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
化学键 | H—H | Cl—Cl | H—Cl |
生成1 mol化学键时放出的能量 | 436 kJ/mol | 243 kJ/mol | 431 kJ/mol |
则下列热化学方程式不正确的是 ( )
A.1/2H2(g)+1/2Cl2(g)===HCl(g)ΔH=-91.5 kJ/mol
B.H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ/mol
C.2HCl(g)===H2(g)+Cl2(g) ΔH=+183 kJ/mol
D.1/2H2(g)+1/2Cl2(g)===HCl(g)ΔH=+91.5 kJ/mol