题目内容
【题目】卤素的单质和化合物种类很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。回答下列问题:
(1)溴原子的价层电子排布图为_______。根据下表提供的第一电离能数据,判断最有可能生成较稳定的单核阳离子的卤素原子是________(填元素符号)。
氟 | 氯 | 溴 | 碘 | |
第一电离能/ (kJ·mol-1) | 1 681 | 1 251 | 1 140 | 1 008 |
(2)氢氟酸在一定浓度的溶液中主要以二分子缔合[(HF)2]形式存在,使氟化氢分子缔合的相互作用是____________。碘在水中溶解度小,但在碘化钾溶液中明显增大,这是由于发生反应:I-+I2=I3-,CsICl2与KI3类似,受热易分解,倾向于生成晶格能更大的物质,试写出CsICl2受热分解的化学方程式:_________________________________。
(3)ClO2-中心氯原子的杂化轨道类型为________,与ClO2-具有相同立体构型和键合形式的物质的化学式为____________(写出一个即可)。
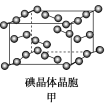
(4)如图甲为碘晶体晶胞结构,平均每个晶胞中有________个碘原子,碘晶体中碘分子的配位数为____________。
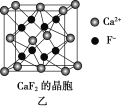
(5)已知NA为阿伏加德罗常数,CaF2晶体密度为ρ g·cm-3,其晶胞如图乙所示,两个最近Ca2+核间距离为a nm,则CaF2的相对分子质量可以表示为____________。
【答案】![]() I 氢键 CsICl2
I 氢键 CsICl2![]() CsCl+ICl sp3 Cl2O(或OF2等) 8 12
CsCl+ICl sp3 Cl2O(或OF2等) 8 12 ![]() a3ρ NA×10-21
a3ρ NA×10-21
【解析】
(1)Br原子的价电子排布式为4s24p5;元素的第一电离能越小,失电子能力越强,越容易失电子成为阳离子;
(2)氢键能使HF分子之间缔合;碘在水中的溶解度小,在碘化钾溶液中明显增大,是由于I-+I2=I3-,CsICl2与KI3类似,受热易分解,倾向于生成晶格能更大的物质CsCl,同时生成ICl,据此写出方程式;
(3)ClO2-中心Cl原子价层电子对数=2+![]() =4,且含有两个孤电子对,根据价层电子对互斥理论判断杂化轨道类型,等电子体空间构型和键合形式相似;
=4,且含有两个孤电子对,根据价层电子对互斥理论判断杂化轨道类型,等电子体空间构型和键合形式相似;
(4)利用均摊法计算;
(5)该晶胞中F-为8个,Ca2+为8×![]() +6×
+6×![]() =4,两个最近Ca2+核间距为a nm=a×10-7cm,晶胞棱长=
=4,两个最近Ca2+核间距为a nm=a×10-7cm,晶胞棱长=![]() a×10-7cm,晶胞的体积V为(
a×10-7cm,晶胞的体积V为(![]() a×10-7)3cm3,则
a×10-7)3cm3,则![]() =
=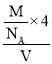 ,代入数据进行计算。
,代入数据进行计算。
(1)Br原子的价电子排布式为4s24p5,价层电子排布图为![]() ;元素的第一电离能越小,失电子能力越强,越容易失电子成为阳离子,由表格中的数据可知,易形成阳离子的是I;
;元素的第一电离能越小,失电子能力越强,越容易失电子成为阳离子,由表格中的数据可知,易形成阳离子的是I;
(2)氢键能使HF分子之间缔合,所以氢键导致HF分子缔合;I2在水中溶解度小,在碘化钾溶液中明显增大,是由于I-+I2=I3-,CsICl2与KI3类似,受热易分解,倾向于生成晶格能更大的物质为CsCl,同时生成ICl,方程式为:CsICl2![]() CsCl+ICl;
CsCl+ICl;
(3)ClO2-中心Cl原子价层电子对数=2+![]() =4,且含有两个孤电子对,根据价层电子对互斥理论可知杂化轨道类型为sp3,等电子体空间构型和键合形式相似,与该离子具有相同立体构型和键合形式的有Cl2O(或OF2等);
=4,且含有两个孤电子对,根据价层电子对互斥理论可知杂化轨道类型为sp3,等电子体空间构型和键合形式相似,与该离子具有相同立体构型和键合形式的有Cl2O(或OF2等);
(4)平均每个晶胞中碘原子的个数=(8×![]() +6×
+6×![]() )×2=8;碘晶体中碘分子的配位数=3×8÷2=12;
)×2=8;碘晶体中碘分子的配位数=3×8÷2=12;
(5)该晶胞中F-为8个,Ca2+为8×![]() +6×
+6×![]() =4,两个最近Ca2+核间距为a nm=a×10-7cm,晶胞棱长=
=4,两个最近Ca2+核间距为a nm=a×10-7cm,晶胞棱长=![]() a×10-7cm,晶胞的体积V为(
a×10-7cm,晶胞的体积V为(![]() a×10-7)3cm3,则
a×10-7)3cm3,则![]() =
=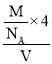 ,M=
,M=![]() =
=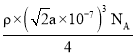 g/mol=
g/mol=![]() a3ρ NA×10-21 g/mol,则CaF2的相对分子质量可以表示为
a3ρ NA×10-21 g/mol,则CaF2的相对分子质量可以表示为![]() a3ρ NA×10-21。
a3ρ NA×10-21。

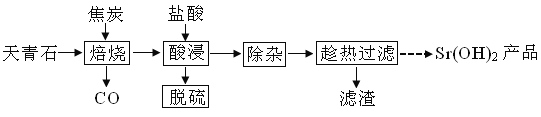
【题目】锶有“金属味精”之称。以天青石(主要含有SrSO4和少量CaCO3、MgO杂质)生产氢氧化锶的工艺如下:
已知氢氧化锶在水中的溶解度:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
溶解度(g/100mL) | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(1)隔绝空气焙烧时SrSO4只被还原成SrS,化学方程式为____。
(2)“除杂”方法:将溶液升温至95℃,加NaOH溶液调节pH为12。
①95℃时水的离子积KW=1.0×10-12,Ksp[Mg(OH)2]=1.2×10-10,则溶液中c(Mg2+)=____。
②若pH过大,将导致氢氧化锶的产率降低,请解释原因____。
(3)“趁热过滤”的目的是____,“滤渣”的主要成分为___。
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为____、过滤、洗涤、干燥。
(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,吸收时的氧化产物为___(填化学式);再用石墨电极电解吸收液,电解后可在“脱硫”中循环利用的物质是__。