题目内容
20.通常情况下.溴是红棕色易挥发,密度比水大的液体.分析 根据溴单质的物理性质分析,从颜色、状态、密度和挥发性等方面回答.
解答 解:通常情况下,溴是红棕色易挥发,密度比水大的液体,故答案为:红棕;挥发;大;液.
点评 本题考查了卤素单质的物质性质,题目难度不大,注意把握溴单质的物理性质.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列离子反应方程式正确的是( )
| A. | 向溶Ca(ClO)2液中通入少量SO2:Ca2++3ClO-+SO2 +H2O═CaSO4 ↓+Cl-+2HClO | |
| B. | 1mol/L的NaAlO2 溶液和2.5mol/L的盐酸等体积均匀混合:2AlO2-+5H+═A l(OH)3 ↓+Al3++H2O | |
| C. | 将11.2L标准状况下的氯气通入200mL 2mol/LFeBr2 的溶液中,离子反应方程式为:2Fe2++8Br-+5Cl2 ═2Fe3++4Br2 +10Cl- | |
| D. | 氢氧化亚铁溶于稀硝酸中:Fe(OH)2 +2H+═Fe2++H2O |
15.下列叙述中,正确的是( )
| A. | 含金属元素的离子一定都是阳离子 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| C. | 金属元素从化合态变为游离态,该元素一定被还原 | |
| D. | 金属阳离子被还原一定得到金属单质 |
5.苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见下表所示: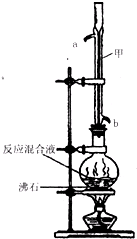
Ⅰ合成苯甲酸甲酯粗产品
在圆底烧瓶中加入0.1mol苯甲酸和0.4mol甲醇,再小心加入3mL浓硫酸,混匀后,投入几粒沸石,小心加热使反应完全,得苯甲酸甲酯粗产品.
甲装置的作用是:冷凝回流;冷却水从b(填“a”或“b”)口进入.
Ⅱ粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制.
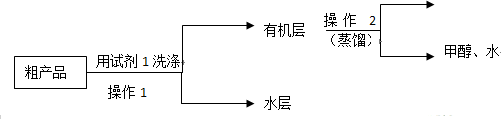
(1)试剂1可以是B(填编号),作用是洗去苯甲酸甲酯中过量的酸.
A.稀硫酸 B.饱和碳酸钠溶液 C.乙醇
(2)操作2中,收集产品时,控制的温度应在199.6℃左右.
(3)实验制得的苯甲酸甲酯精品质量为10g,则苯甲酸的转化率为73.5%.(结果保留三位有效数字)

| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/℃ | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
在圆底烧瓶中加入0.1mol苯甲酸和0.4mol甲醇,再小心加入3mL浓硫酸,混匀后,投入几粒沸石,小心加热使反应完全,得苯甲酸甲酯粗产品.
甲装置的作用是:冷凝回流;冷却水从b(填“a”或“b”)口进入.
Ⅱ粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制.

(1)试剂1可以是B(填编号),作用是洗去苯甲酸甲酯中过量的酸.
A.稀硫酸 B.饱和碳酸钠溶液 C.乙醇
(2)操作2中,收集产品时,控制的温度应在199.6℃左右.
(3)实验制得的苯甲酸甲酯精品质量为10g,则苯甲酸的转化率为73.5%.(结果保留三位有效数字)
2.将1molCO和1molNO2充入密闭容器中,在催化剂存在下发生反应NO2(g)+CO(g)?CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2.在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中的CO2的体积分数是( )
| A. | $\frac{1}{9}$ | B. | $\frac{1}{6}$ | C. | $\frac{2}{9}$ | D. | $\frac{1}{3}$ |
3.下表给出了五种元素的相关信息,其中A、B、C、D为短周期元素.根据以下信息填空:
(1)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1:2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式:2N2H4+N2O4═3N2+4H2O.
(2)化合物X是元素D的最高价氧化物的水化物,X在水中的电离方程为H2SO4═2H++SO42-;常温下,E的单质与化合物X反应生成盐Y,Y的化学式是FeSO4.化合物Z仅由元素D和E组成,2Z+2H2O+7O2═2X+2Y,产物中n(X):n(Y)=1:1,写出并配平上述方程式:2FeS2+2H2O+7O2═2FeSO4+2H2SO4.
(3)盐Y受强热会发生分解反应,其气体产物由元素D的氧化物组成,请设计一个可行的定性实验,验证其气体产物中所含元素D的氧化物的组成将气体产物通入品红溶液,如果品红溶液褪色,则含有SO2,反之则无SO2.取适量吸收液于试管,滴加适量盐酸酸化,再滴加BaCl2,如有白色沉淀生成,则含有SO3,反之则无SO3.
| 元素 | 相关信息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D | 室温下其单质为淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E | 它在地壳中储量丰富,是人体不可缺少的微量元素之一.其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
(2)化合物X是元素D的最高价氧化物的水化物,X在水中的电离方程为H2SO4═2H++SO42-;常温下,E的单质与化合物X反应生成盐Y,Y的化学式是FeSO4.化合物Z仅由元素D和E组成,2Z+2H2O+7O2═2X+2Y,产物中n(X):n(Y)=1:1,写出并配平上述方程式:2FeS2+2H2O+7O2═2FeSO4+2H2SO4.
(3)盐Y受强热会发生分解反应,其气体产物由元素D的氧化物组成,请设计一个可行的定性实验,验证其气体产物中所含元素D的氧化物的组成将气体产物通入品红溶液,如果品红溶液褪色,则含有SO2,反之则无SO2.取适量吸收液于试管,滴加适量盐酸酸化,再滴加BaCl2,如有白色沉淀生成,则含有SO3,反之则无SO3.
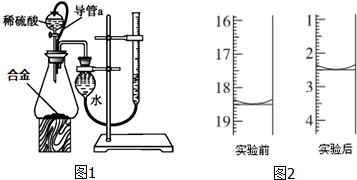 可利用以下方法测定铝镁合金(不含其它元素)组分含量
可利用以下方法测定铝镁合金(不含其它元素)组分含量