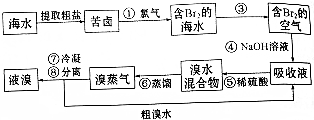
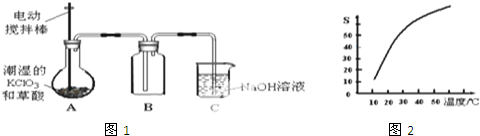
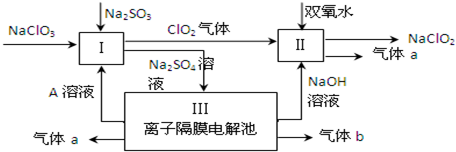
题目内容
13.元素周期表有多种形式.如图是一种三角形元素素周期表的一部分,下列说法正确的是( )
| A. | M的氧化物易溶于水 | |
| B. | 碳的最简单氢化物的稳定性强于A的 | |
| C. | 钾和B组成的化合物的水溶液显碱性 | |
| D. | A、B形成的化合物中可能含有离子键 |
分析 由元素在周期表中位置可知,R处于第二周期、ⅤA族,为N元素;A处于第二周期、ⅥA族,为O元素;M处于第三周期、ⅢA族,为Al元素;B与A同主族,且位于A的下一周期,则B为S元素,然后结合元素周期律的知识对各选项进行判断.
解答 解:由元素在周期表中的相对位置可知,R处于第二周期、ⅤA族,为N元素;A处于第二周期、ⅥA族,为O元素;M处于第三周期、ⅢA族,为Al元素;B与A同主族,且位于A的下一周期,则B为S元素,
A.M为Al,其氧化物为氧化铝,氧化铝不溶于水,故A错误;
B.A为O元素,非金属性越强,对应的气态氢化物的稳定性越强,非金属性O>C,则水的稳定性大于甲烷,即:碳的最简单氢化物的稳定性小于A的,故B错误;
C.B为S,二者形成的化合物为硫化钾,硫离子部分水解,溶液显示碱性,故C正确;
D.A为O、B为S,二者形成的化合物为二氧化硫、三氧化硫,都属于共价化合物,不存在离子键,故D错误;
故选C.
点评 本题考查了元素周期表结构及其应用,题目难度中等,正确推断元素为解答关键,注意熟练掌握元素周期表结构、元素周期律的内容,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
8.下列离子反应方程式正确的是( )
| A. | 向溶Ca(ClO)2液中通入少量SO2:Ca2++3ClO-+SO2 +H2O═CaSO4 ↓+Cl-+2HClO | |
| B. | 1mol/L的NaAlO2 溶液和2.5mol/L的盐酸等体积均匀混合:2AlO2-+5H+═A l(OH)3 ↓+Al3++H2O | |
| C. | 将11.2L标准状况下的氯气通入200mL 2mol/LFeBr2 的溶液中,离子反应方程式为:2Fe2++8Br-+5Cl2 ═2Fe3++4Br2 +10Cl- | |
| D. | 氢氧化亚铁溶于稀硝酸中:Fe(OH)2 +2H+═Fe2++H2O |
18.下列物质中,既能与硫化氢应,又能与溴水反应的是( )
①硫化钠溶液 ②二氧化硫饱和溶液 ③硫酸铜溶液 ④硝酸银溶液 ⑤亚硫酸钠溶液.
①硫化钠溶液 ②二氧化硫饱和溶液 ③硫酸铜溶液 ④硝酸银溶液 ⑤亚硫酸钠溶液.
| A. | ①②③④⑤ | B. | ①③⑤ | C. | ①②④⑤ | D. | ②④⑤ |
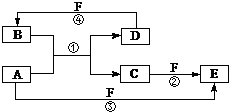 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).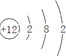 ;反应④的化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.
;反应④的化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O. ,反应①的化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
,反应①的化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.