题目内容
19.高锰酸钾是锰的重要化合物和常用的氧化剂.以下是工业上用软锰矿制备高锰酸钾的一种工艺流程.20℃时溶解度(克/100克水),K2CO3:111,KMnO4:6.34.
(1)KMnO4稀溶液是一种常用的消毒剂.其消毒机理与下列BD(填序号)物质相似.
A.75%酒精 B.双氧水 C.苯酚 D.NaClO溶液
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:2MnO2+4KOH+O2 $\frac{\underline{\;熔融\;}}{\;}$2K2MnO4+2H2O.
(3)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂和氧化剂之比是2:1.
(4)上述流程中可以循环使用的物质有石灰、二氧化碳、KOH和MnO2.
(5)若不考虑物质循环与制备过程中的损失,则1mol MnO2可制得$\frac{2}{3}$或0.67mol KMnO4.
(6)操作Ⅰ的名称是过滤;操作Ⅱ是采用蒸发结晶(填操作步骤)、趁热过滤得到KMnO4粗晶体.
(7)一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4•H2C2O4•2H2O.若用c mol/L的NaOH溶液中和相同质量的KHC2O4•H2C2O4•2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的a倍,则KMnO4溶液的浓度为$\frac{4ac}{15}$ (mol•L-1)(提示:①H2C2O4是二元弱酸②10[KHC2O4•H2C2O4]+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O )
分析 由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2,通过过滤,分离出二氧化锰,滤液中含KMnO4和K2CO3,根据KMnO4和K2CO3在溶解性上不同采用蒸发结晶的方式可分离出高锰酸钾和碳酸钾,对粗高锰酸钾进行重结晶、干燥得到纯净的高锰酸钾;向碳酸钾溶液中加入石灰生成碳酸钙和氢氧化钠,
(1)高锰酸钾具有强氧化性,常常利用高锰酸钾的强氧化性进行消毒;
(2)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水.反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为-2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数,根据钾元素守恒确定KOH系数,根据氢元素守恒确定H2O系数;
(3)由工艺流程转化关系可知,向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2,所含元素化合价升升降总数相等来确定氧化剂和还原剂的物质的量之比;
(4)制备中利用的原料,在转化过程中又生成的可以循环利用;
(5)根据氧化还原反应中得失电子守恒计算高锰酸钾和二氧化锰的比值;
(6)分离固体与溶液,采用过滤操作,利用KMnO4和K2CO3在溶解性上进行分离;
(7)两反应中KHC2O4•H2C2O4•2H2O的物质的量相同,设其物质的量为1mol,H2C2O4是二元弱酸,所以1molKHC2O4•H2C2O4•2H2O可以中和氢氧化钠3mol,根据V=$\frac{n}{c}$计算氢氧化钠溶液的体积,进而计算高锰酸钾溶液的体积,由方程式10[KHC2O4•H2C2O4]+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O计算1molKHC2O4•H2C2O4反应需要KMnO4的物质的量,最后根据c=$\frac{n}{V}$计算高锰酸钾溶液的浓度.
解答 解:由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2,通过过滤,分离出二氧化锰,滤液中含KMnO4和K2CO3,根据KMnO4和K2CO3在溶解性上不同采用蒸发结晶的方式可分离出高锰酸钾和碳酸钾,对粗高锰酸钾进行重结晶、干燥得到纯净的高锰酸钾;向碳酸钾溶液中加入石灰生成碳酸钙和氢氧化钠,
(1)高锰酸钾具有强氧化性,常常利用高锰酸钾的强氧化性进行消毒.
A、75%酒精是通过酒精渗透到细菌体内,使细菌蛋白质凝固(变性),从而杀死细菌,故A错误;
B、双氧水具有强氧化性,常常利用双氧水的强氧化性进行杀菌消毒,故B正确;
C、苯酚是通过渗透到细菌体内,使细菌蛋白质凝固(变性),从而杀死细菌,故C错误;
D、NaClO溶液中次氯酸钠具有强氧化性,常常利用次氯酸钠的强氧化性进行杀菌消毒,故D正确,
故选BD;
(2)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水.反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为-2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数为2,根据钾元素守恒确定KOH系数为4,根据氢元素守恒确定H2O系数为2,所以反应化学方程式为2MnO2+4KOH+O2 $\frac{\underline{\;熔融\;}}{\;}$2K2MnO4+2H2O,
故答案为:2MnO2+4KOH+O2 $\frac{\underline{\;熔融\;}}{\;}$2K2MnO4+2H2O;
(3)由工艺流程转化关系可知,向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2,反应只有Mn元素的化合价发生变化,由+6价降低为+4价,降低2,由+6价升高为+7价,升高1,所以K2MnO4既是氧化剂又是还原剂,根据升高和降低总数相等,升高和降低锰元素之比为2:1,即氧化剂和还原剂物质的量之比为2:1,
故答案为:2:1;
(4)制备中利用的原料,在转化过程中又生成的可以循环利用.由转化关系图知,除石灰、二氧化碳外,K2MnO4溶液中通入CO2以制备KMnO4生成的MnO2及最后由母液加入石灰生成的KOH,会在MnO2、KOH的熔融制备K2MnO4中被循环利用,
故答案为:KOH;MnO2;
(5)锰酸钾和二氧化碳反应的方程式为 3K2MnO4+2CO2=2KMnO4+MnO2+2K2CO3,根据方程式知,1molK2MnO4和二氧化碳反应生成$\frac{2}{3}$mol或0.67molKMnO4,
故答案为:$\frac{2}{3}$或0.67;
(6)该操作是分离固体与溶液,是过滤操作,KMnO4和K2CO3在溶解性上不同采用蒸发结晶的方式可分离,
故答案为:过滤;蒸发结晶;
(7)两反应中KHC2O4•H2C2O4•2H2O的物质的量相同,设其物质的量为1mol,H2C2O4是二元弱酸,
所以1molKHC2O4•H2C2O4•2H2O可以中和氢氧化钠3mol,恰好中需要氢氧化钠溶液的体积为:$\frac{3mol}{cmol/L}$=$\frac{3}{c}$L,
所以高锰酸钾溶液的体积为:$\frac{3}{c}$L×$\frac{1}{a}$=$\frac{3}{ac}$L,由方程式10[KHC2O4•H2C2O4]+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O
可知1molKHC2O4•H2C2O4反应需要KMnO4的物质的量为:$\frac{8}{10}$×1mol=0.8mol,
所以高锰酸钾溶液的浓度为:$\frac{0.8}{\frac{3}{ac}}$mol/L=$\frac{4ac}{15}$mol/L,
故答案为:$\frac{4ac}{15}$.
点评 本题考查常见氧化剂与还原剂、氧化还原反应、化学计算和对工艺流程的理解、阅读题目获取信息的能力等,解答本题时要充分理解图中提供的信息,只有理解了图中信息才能对问题做出正确的判断,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | Cu$\stackrel{浓硝酸}{→}$ Cu(NO3)2 | B. | Cu$\stackrel{稀硝酸}{→}$Cu(NO3)2 | ||
| C. | Cu$\stackrel{硝酸银溶液}{→}$Cu(NO3)2 | D. | Cu $\stackrel{氧气}{→}$CuO$\stackrel{稀硝酸}{→}$Cu(NO3)2 |
是( )
①单位时间内生成nmolO2的同时生成2nmolNO
②单位时间内消耗nmolO2的同时消耗2nmolNO2
③v正(NO2):v正(NO):v正(O2)=2:2:1的状态
④混合气体的密度不再改变的状态
⑤混合气体的颜色不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态.
| A. | ②④⑤ | B. | ②⑤⑥ | C. | ②③④⑥ | D. | ①④⑤⑥ |
| A. | pH=1或pH=13 | |
| B. | 阴离子肯定没有I -,不能确定有无HCO3- | |
| C. | 阳离子肯定没有Fe3+,不能确定有无Na+ | |
| D. | 溶质有3种可能:①HI ②HI和NaI ③NaI和NaOH |
 利用化学反应原理解决下列问题.
利用化学反应原理解决下列问题. △H=+124kJ•mol-1
△H=+124kJ•mol-1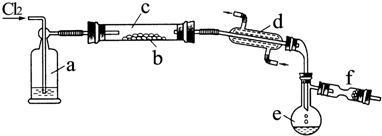
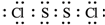 .
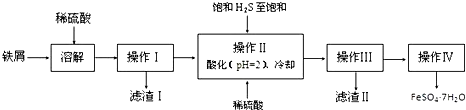
.
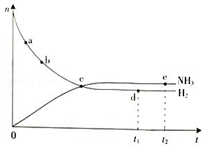 合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题:
合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题: