题目内容
9.25℃时,某溶液中含有Na+、H+、Fe3+、HCO3-、OH-、I-中的几种离子,已知由水电离出的C(H+)=1×10-13mol•L-1.向该溶液中缓慢通入一定量的Cl2后,溶液由无色变为黄色.下列关于该溶液的分析,错误的是( )| A. | pH=1或pH=13 | |
| B. | 阴离子肯定没有I -,不能确定有无HCO3- | |
| C. | 阳离子肯定没有Fe3+,不能确定有无Na+ | |
| D. | 溶质有3种可能:①HI ②HI和NaI ③NaI和NaOH |
分析 水电离出的c(H+)=1×lO-13 mol/L,溶液中氢离子或氢氧根离子浓度为0.1mol/L,该溶液为强酸性或碱性溶液,一定不会存在碳酸氢根离子;当向该溶液中缓慢通入一定量的Cl2后,溶液由无色变为黄色,说明溶液中一定存在碘离子,能够与碘离子反应的铁离子一定不会存在,以此解答该题.
解答 解:由水电离出的c(H+)=1×lO-13 mol/L,该溶液中大量存在氢离子或者氢氧根离子,所以溶液中一定不会存在碳酸氢根离子;通入氯气后溶液由无色变为黄色,说明溶液中一定不会存在有色的铁离子,一定存在碘离子,
A.根据分析可知,水电离出的c(H+)=1×lO-13 mol/L,若为酸性溶液,该溶液pH=1;若为碱性溶液,该溶液的pH为13,故A正确;
B.该溶液中一定存在碘离子,一定不会存在HCO3-,故B错误;
C.溶液中一定不会存在铁离子,不能确定是否存在钠离子,故C正确;
D.如果为酸性溶液,则溶质可能为:①HI②HI和NaI;如果为碱性溶液,则溶质为③NaI和NaOH,故D正确;
故选B.
点评 本题考查了常见离子的检验方法,为高频考点,题目难度中等,注意明确常见离子的反应现象及检验方法,试题有利于培养学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.在某溶液中滴加用硝酸酸化的氯化钡溶液,有白色沉淀生成,则该溶液中( )
| A. | 一定含有SO42- | B. | 一定含有Ag+ | ||
| C. | 一定含有SO42-和Ag+ | D. | 可能含有SO42-或Ag+ |
4.下列实验中,有关仪器的下端必须插入液面以下的是( )
①制备乙酸乙酯时,将乙酸乙酯蒸气通入饱和Na2CO3溶液的导管
②制备氯气装置中的分液漏斗
③制备氨水时将氨气溶于水的导管
④制备氢气的简易装置中加入稀硫酸用的长颈漏斗
⑤分馏石油时的温度计.
①制备乙酸乙酯时,将乙酸乙酯蒸气通入饱和Na2CO3溶液的导管
②制备氯气装置中的分液漏斗
③制备氨水时将氨气溶于水的导管
④制备氢气的简易装置中加入稀硫酸用的长颈漏斗
⑤分馏石油时的温度计.
| A. | ①②④ | B. | ④ | C. | ①②③ | D. | ②③④ |
14.在4个密闭容器中分别充入N2、O2、H2、CO2四种气体,当它们的温度、体积和密度都相同时,压强最小的是( )
| A. | CO2 | B. | N2 | C. | H2 | D. | O2 |
19.全钒液流电池是一种新型的绿色环保储能电池.其电池总反应为:
V3++VO2++H2O VO2++2H++V2+,下列说法正确的是( )
VO2++2H++V2+,下列说法正确的是( )
V3++VO2++H2O
 VO2++2H++V2+,下列说法正确的是( )
VO2++2H++V2+,下列说法正确的是( )| A. | 放电时每转移2mol电子时,消耗1mol氧化剂 | |
| B. | 放电时正极反应为:VO+2+2H++e-=VO2++H2O | |
| C. | 放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极 | |
| D. | 充电过程中,H+由阴极区移向阳极区迁移 |

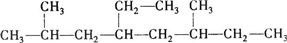 ,那么 1mol该烃完全燃烧需消耗氧气的量为18.5mol.
,那么 1mol该烃完全燃烧需消耗氧气的量为18.5mol.