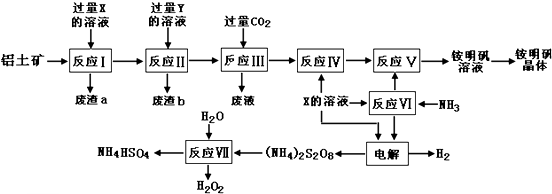
题目内容
7.氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃.在空气中强烈发烟,易与水发生水解反应.人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能.在熔融的硫中通入氯气即可生成S2Cl2.如图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去).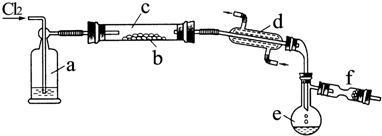
(1)仪器名称:d冷凝管;e蒸馏烧瓶.
(2)已知S2Cl2分子中各原子最外层均满足8电子稳定结构,则S2Cl2的电子式
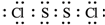 .
.(3)装置a中应放试剂为浓H2SO4,其作用为干燥Cl2.
(4)该实验的操作顺序应为②③①⑤④(或③②①⑤④) (用序号表示).
①加热装置C ②通入Cl2 ③通入冷水 ④停止通Cl2 ⑤停止加热装置C
(5)f装置中应放置的试剂为碱石灰,其作用为吸收Cl2尾气,防止污染环境,防止空气中的水汽加使S2Cl2水解.
(6)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式2S2Cl2+2H2O═SO2+3S+4HCl.
分析 (1)根据仪器的形状确定名称;
(2)S2Cl2分子结构与H2O2相似,S2Cl2分子中氯原子与硫原子之间形成1对共用电子对,硫原子与硫原子之间形成1对共用电子对;
(3)由信息可知S2Cl2遇水水解,进入b中的气体应该干燥,用浓硫酸干燥;
(4)加热之前先通冷凝水,否则开始生成的S2Cl2不能冷却液化,最后先停止加热后停止通氯气,平衡容器内压强,防止发生危险;
(5)f装置盛放碱石灰,吸收Cl2尾气,防止空气中的水汽加入e中;
(6)只有硫元素化合价发生变化,根据被氧化和被还原的该元素的物质的量之比为1:3书写.
解答 解:(1)冷凝蒸气一般用冷凝管,d为直形冷凝管(或冷凝管),e为蒸馏烧瓶,
故答案为:直形冷凝管(或冷凝管);蒸馏烧瓶;
(2)S2Cl2分子结构与H2O2相似,S2Cl2分子中氯原子与硫原子之间形成1对共用电子对,硫原子与硫原子之间形成1对共用电子对,S2Cl2电子式为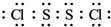 ,
,
故答案为: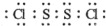 ;
;
(3)由信息可知S2Cl2遇水水解,进入b中的气体应该干燥,浓硫酸具有吸水性且与氯气不反应,所以a中应放试剂为浓硫酸,其作用为干燥氯气,
故答案为:浓H2SO4;干燥Cl2;
(4)加热之前先通冷凝水,否则开始生成的S2Cl2不能冷却液化,最后先停止加热后停止通氯气,平衡容器内压强,防止发生危险.所以实验操作顺序为②③①⑤④(或③②①⑤④);
故答案为:②③①⑤④(或③②①⑤④);
(5)氯气有毒,为酸性气体,f装置盛放碱石灰,吸收Cl2尾气,防止污染环境,防止空气中的水汽加入e中使S2Cl2水解,
故答案为:碱石灰;吸收Cl2尾气,防止污染环境,防止空气中的水汽加使S2Cl2水解;
(6)只有硫元素化合价发生变化,反应中硫元素从+1价部分变为+4价,得氧化产物为SO2,部分变为0价,得还原产物为S,且被氧化和被还原的物质的量之比为1:3,化学方程式:2S2Cl2+2H2O=SO2↑+3S↓+4HCl,
故答案为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl.
点评 本题考查学生对实验原理及装置的理解、评价,阅读题目获取信息的能力等,关键是掌握整个制备流程原理,分析流程中各装置的作用,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力,难度中等.

| A. | NaCl | B. | NaHCO3 | C. | 浓H2SO4 | D. | Na2SO3 |
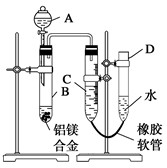 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.