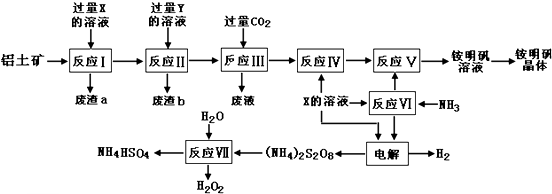
题目内容
4.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.
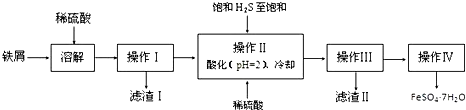
(1)检验制得的绿矾晶体中是否含有Fe3+的实验操作是取少量晶体溶于水,滴加KSCN溶液,若溶液不显红色,则溶液中不含Fe3+.
(2)操作Ⅱ中,通入硫化氢至饱和的目的是除去溶液中的Sn2+离子;在溶液中用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀.
(3)操作Ⅳ的顺序依次为:蒸发浓缩、冷却结晶、过滤、洗涤.
(4)测定绿矾产品中Fe2+含量的方法是:
a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol?L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①已知KMnO4酸性溶液与Fe2+反应时被还原为Mn2+,请写出该反应的离子方程式:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O;
②计算上述样品中FeSO4?7H2O的质量分数为0.975(用小数表示,保留三位小数).
分析 铁屑加入稀硫酸生成硫酸亚铁、硫酸锡,过滤后得到滤液,将滤液加入稀硫酸酸化,并通入硫化氢,可生成SnS沉淀并防止亚铁离子被氧化,过滤后得到滤液为硫酸亚铁,经蒸发浓硫酸、冷却结晶、过滤可得到FeSO4•7H2O,
(1)KSCN溶液遇铁离子溶液呈血红色,所以可以用KSCN溶液检验铁离子;
(2)依据流程关系图分析,通入硫化氢制饱和,硫化氢是强还原剂,目的是沉淀锡离子,防止亚铁离子被氧化;在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,操作Ⅱ加入稀硫酸调节溶液PH=2为了除去杂质离子Sn2+;
(3)操作IV的目的是从滤液中析出绿矾晶体,利用蒸发浓缩,结晶洗涤得到晶体;
(4)①KMnO4酸性溶液与Fe2+反应时被还原为Mn2+,亚铁离子被氧化成铁离子,根据电荷守恒和元素守恒书写离子方程式;
②依据滴定实验的反应终点时发生的反应为 5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,由消耗的高锰酸钾的物质的量可求得亚铁离子的物质的量,即FeSO4•7H2O的物质的量,由此计算出样中纯FeSO4•7H2O的质量,进而计算样品中FeSO4•7H2O的质量分数.
解答 解:铁屑加入稀硫酸生成硫酸亚铁、硫酸锡,过滤后得到滤液,将滤液加入稀硫酸酸化,并通入硫化氢,可生成SnS沉淀并防止亚铁离子被氧化,过滤后得到滤液为硫酸亚铁,经蒸发浓硫酸、冷却结晶、过滤可得到FeSO4•7H2O,
(1)KSCN溶液遇铁离子溶液呈血红色,所以可以用KSCN溶液检验铁离子,具体操作为取少量晶体溶于水,滴加KSCN溶液,若溶液不显红色,则溶液中不含Fe3+,
故答案为:取少量晶体溶于水,滴加KSCN溶液,若溶液不显红色,则溶液中不含Fe3+;
(2)通入硫化氢至饱和的目的是:硫化氢具有强还原性,可以防止亚铁离子被氧化,已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是,在溶液PH=2时,Sn2+完全沉淀,亚铁离子不沉淀,
故答案为:除去溶液中的Sn2+离子;防止Fe2+离子生成沉淀;
(3)溶液中得到晶体,需要对溶液进行加热蒸发浓缩,结晶析出,过滤洗涤等,所以操作IV的顺序依次为:蒸发浓缩、冷却结晶、过滤、洗涤,
故答案为:蒸发浓缩;过滤、洗涤;
(4)①KMnO4酸性溶液与Fe2+反应时被还原为Mn2+,亚铁离子被氧化成铁离子,反应的离子方程式为5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,
故答案为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O;
②a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL,则
5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5 1
n(Fe2+) 0.01000mol/L×0.0200L
计算得到;n(Fe2+)=0.001mol;
则250mL溶液中含Fe2+=0.001mol×$\frac{250}{25}$=0.01mol;
FeSO4•7H2O物质的量为0.01mol,质量=0.01mol×278g/mol=2.78g;
质量分数=$\frac{2.78g}{2.85g}$×100%=0.975,
故答案为:0.975.
点评 本题考查了铁盐亚铁盐的性质应用,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力的考查,题目着重于分离混合物的实验方法设计和分析判断的考查,注意把握滴定实验的分析判断,数据计算,误差分析的方法,题目难度中等.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案| A. | 铁质菜刀生锈 | B. | 燃放烟花爆竹 | C. | 食物腐败变质 | D. | 煅烧石灰石 |
| A. | NaCl | B. | NaHCO3 | C. | 浓H2SO4 | D. | Na2SO3 |
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A. | 0~4s容器内的压强逐渐增大 | |
| B. | 生成Cl2的平均反应速率,0~2s比2~4s快 | |
| C. | 8s时向容器中再充入一定量的氦气,反应速率又会加快 | |
| D. | 该条件下,COCl2的最大转化率为40% |
| A. | CO2 | B. | N2 | C. | H2 | D. | O2 |