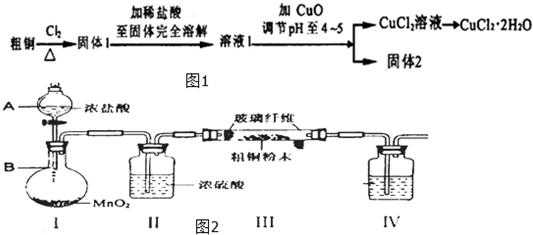
题目内容
14.由铜制备硝酸铜,考虑到生产成本和减少污染,下列最合理的方法是( )| A. | Cu$\stackrel{浓硝酸}{→}$ Cu(NO3)2 | B. | Cu$\stackrel{稀硝酸}{→}$Cu(NO3)2 | ||
| C. | Cu$\stackrel{硝酸银溶液}{→}$Cu(NO3)2 | D. | Cu $\stackrel{氧气}{→}$CuO$\stackrel{稀硝酸}{→}$Cu(NO3)2 |
分析 绿色化学的理念是原料的利用率高,对环境无污染,因此从这二个方面分析制备等质量硝酸铜需要的原料及对环境是否存在污染来考虑,据此可选择最合理的选项;
A.Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,反应生成有毒气体;
B.3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,反应生成有毒气体;
C.Cu+2AgNO3═Cu(NO3)2+2Ag,硝酸银比较昂贵,原料成本高;
D.2Cu+O2$\frac{\underline{\;加热\;}}{\;}$2CuO,CuO+2HNO3=Cu(NO3)2+H2O,消耗的硝酸较少且产物没有污染.
解答 解:A.生成1mol硝酸铜,消耗4mol硝酸,同时产生二氧化氮有毒气体,故A不选;
B.生成1mol硝酸铜,消耗$\frac{8}{3}$mol硝酸,同时产生一氧化氮有毒气体,故B不选;
C.反应消耗硝酸银,成本较高,故C不选;
D.生成1mol硝酸铜,消耗2mol硝酸,成本低,没有有毒气体产生,故D选;
故选D.
点评 本题考查了铜和硝酸的性质,制备硝酸铜时应注意生产成本和环境污染,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.制取水煤气的反应为C(s)+H2O(g)═CO(g)+H2(g)△H>0,欲提高反应的速率和C(s)的转化率,可采用的措施为( )
| A. | 降温 | B. | 增大水蒸气的浓度 | ||
| C. | 增大C(s)的量 | D. | 增大压强 |
6.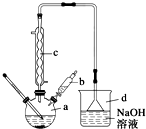 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液、10mL 水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品.
(1)仪器a的名称是三颈烧瓶.
(2)将b中的液溴慢慢加入到a中,而不能快速加入的原因是防止反应放出的热使C6H6、Br2挥发而影响产率.
(3)仪器c的作用是冷凝回流,回流的主要物质有C6H6、Br2 (填化学式).
(4)步骤4得到的粗产品中还含有杂质苯.已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是蒸馏.
 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液、10mL 水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品.
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
(2)将b中的液溴慢慢加入到a中,而不能快速加入的原因是防止反应放出的热使C6H6、Br2挥发而影响产率.
(3)仪器c的作用是冷凝回流,回流的主要物质有C6H6、Br2 (填化学式).
(4)步骤4得到的粗产品中还含有杂质苯.已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是蒸馏.
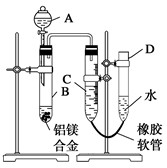 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.