题目内容
18.下列离子方程式正确的是( )| A. | 水中加入钠:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 碳酸氢钙溶液加入盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 氢氧化铜中加入盐酸:OH-+H+═H2O | |
| D. | 碳酸镁跟稀硫酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
分析 A.电荷不守恒;
B.碳酸氢根离子为多元弱酸的酸式根离子,不能拆;
C.氢氧化铜中加入盐酸反应生成氯化铜和水,氢氧化铜为弱电解质,应保留化学式;
D.碳酸镁与盐酸反应生成氯化镁和水、二氧化碳.
解答 解:A.钠与水反应离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.碳酸氢钙溶液加入盐酸,离子方程式:HCO3-+H+═CO2↑+H2O,故B错误;
C.氢氧化铜中加入盐酸,离子方程式:Cu(OH)2+2H+═2H2O+Cu2+,故C错误;
D.碳酸镁跟稀硫酸反应:MgCO3+2H+═Mg2++H2O+CO2↑,故D正确;
故选:D.
点评 本题考查了离子方程式的书写正误判断,明确反应实质是解题关键,注意化学式的拆分及反应遵循原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
相关题目
8.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上常采用下列反应合成甲醇:CO(g)+2H2(g)═CH3OH(g)△H1
①下表所列数据是上述反应在不同温度下的化学平衡常数(K).
由表中数据判断△H1<0 (填“>”、“=”或“<”).
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%.
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g);△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g);△H=-566.0kJ/mol
③H2O(g)=H2O(l);△H=-44.0kJ/mol
请计算1mol甲醇不完全燃烧生成1mol一氧化碳和液态水放出的热量为266.8kJ.
(1)工业上常采用下列反应合成甲醇:CO(g)+2H2(g)═CH3OH(g)△H1
①下表所列数据是上述反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%.
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g);△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g);△H=-566.0kJ/mol
③H2O(g)=H2O(l);△H=-44.0kJ/mol
请计算1mol甲醇不完全燃烧生成1mol一氧化碳和液态水放出的热量为266.8kJ.
9.有体积相同、pH相等的烧碱溶液和氨水,下列叙述中正确的是( )
| A. | 两溶液中OH-离子浓度相同 | |
| B. | 用同浓度的盐酸中和时,消耗盐酸的体积相同 | |
| C. | 两溶液溶质物质的量浓度相同 | |
| D. | 加入等体积的水稀释后,它们的pH仍相等 |
13.三种黑色粉末:二氧化锰、木炭粉、氧化铜.可将它们区分开的一种物质是(允许加热)( )
| A. | 红墨水 | B. | 稀硫酸 | C. | 稀盐酸 | D. | 浓盐酸 |
3.水质检测的项目中不包含( )
| A. | 水温、pH | B. | 导电率、固体悬浮物 | ||
| C. | 氮的氧化物 | D. | DO、COD、BOD |
10.下列各组名词或现象中,三者间有逐级因果关系的是( )
| A. | 汽车尾气-------光化学污染-------咳嗽和气喘者增多 | |
| B. | 含磷洗衣粉--------水体富营养化--------水栖生物大量死亡 | |
| C. | 人口增多--------空气中CO2浓度增大--------温室效应 | |
| D. | 氟氯烃--------臭氧空洞--------皮肤癌患者增多 |
 哈伯因为氨气的合成曾获1918年诺贝尔奖.
哈伯因为氨气的合成曾获1918年诺贝尔奖.

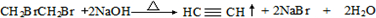
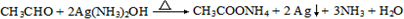
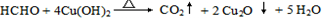
 .
.