题目内容
17.下列推论正确的是( )| A. | 由“HF比HCl稳定性好”,可推知HF比HCl沸点高 | |
| B. | 由“同温度下等浓度的Na2CO3溶液比Na2SO4溶液的pH大”,可推知C比S的非金属性弱 | |
| C. | 由“相同条件下,HF比HCl溶液的酸性弱”,可推知氟的非金属性小于氯的非金属性 | |
| D. | 由“某过程发生化学键断裂”,可推知该过程发生了化学变化 |
分析 A.元素的非金属性越强,其氢化物的稳定性越强,与氢化物的熔沸点无关;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,其酸根离子水解程度越小,则相同浓度的钠盐溶液pH越小;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,与其氢化物水溶液酸性强弱无关;
D.有化学键断裂不一定有化学键形成,所以不一定发生化学反应.
解答 解:A.元素的非金属性越强,其氢化物的稳定性越强,与氢化物的熔沸点无关,氢化物的熔沸点与分子间作用力和氢键有关,所以不能由“HF比HCl稳定性好”,可推知HF比HCl沸点高,故A错误;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,其酸根离子水解程度越小,则相同浓度的钠盐溶液pH越小,所以由“同温度下等浓度的Na2CO3溶液比Na2SO4溶液的pH大”知,硫酸酸性大于碳酸,可推知C比S的非金属性弱,故B正确;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,与其氢化物水溶液酸性强弱无关,所以不能由“相同条件下,HF比HCl溶液的酸性弱”判断知氟的非金属性小于氯的非金属性,故C错误;
D.有化学键断裂不一定有化学键形成,所以不一定发生化学反应,如电解质的电离过程就发生化学键的断裂但不发生化学反应,故D错误;
故选B.
点评 本题考查非金属性强弱判断、化学反应实质等知识点,明确元素周期律内涵及化学反应实质特点即可解答,易错选项是D.

练习册系列答案
相关题目
7.下列说法正确的是( )
| A. | SiO2晶体易溶于水,水溶液呈现酸性 | |
| B. | CO2通入水玻璃中不可能得到硅酸 | |
| C. | SiO2是酸性氧化物,它不溶于任何酸 | |
| D. | SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑是制造玻璃的反应之一 |
8.某溶液中有Fe2+、Mg2+、Al3+、Fe3+等四种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中大量减少的阳离子是( )
| A. | Fe2+ | B. | Mg2+ | C. | Al3+ | D. | Fe3+ |
5.如图,有关铁钉腐蚀(除②外,电解质溶液为食盐水)说法不正确的是( )
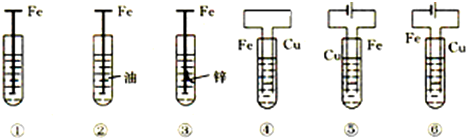

| A. | ③是牺牲阳极的阴极保护法 | |
| B. | 若将⑥的Cu极换成不溶性电极,则⑥是外加电流的阴极保护法 | |
| C. | 腐蚀快到慢的顺序为⑤>④>①>⑥>③>② | |
| D. | ①发生析氢腐蚀 |
12.下列各组稀溶液:①氨水和硝酸银 ②NaAlO2和盐酸 ③硫酸氢钠和氢氧化钡 ④硝酸和碳酸钠.只用试管、滴管及闻气味就能鉴别的是( )
| A. | ③④ | B. | ①②④ | C. | ①②③④ | D. | ②④ |
2.阿司匹林是一种常用的退热、镇痛药物,其结构简式如图:下列有关阿司匹林的叙述正确的是( )
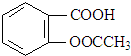

| A. | 阿司匹林的分子式为C9H8O4 | |
| B. | 阿司匹林苯环上的一氯取代物有2种 | |
| C. | 阿司匹林能与NaHCO3溶液反应,最多能与5 mol H2发生加成反应 | |
| D. | 1 mol 阿司匹林与足量NaOH溶液反应,最多消耗NaOH的量为2 mol |
6.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.56 L甲烷中含有的共价键数为0.1NA | |
| B. | 标准状况下,1mol SO3含有的氧原子数为3NA | |
| C. | 3mol NO2和足量H2O反应,转移1 NA个电子 | |
| D. | pH=1的稀硫酸中含有的H+数为0.1NA |
7.用胶头滴管向用石蜡围成的“spark”凹槽内注入某溶液,即可在玻璃上刻蚀出“spark”的字样,则该溶液是( )
| A. | 盐酸 | B. | 氢氟酸 | C. | 烧碱 | D. | 饱和食盐水 |