题目内容
11.下列实验操作正确的是( )| A. | 固体碘与NH4Cl的混合物可以用加热升华的方法分离 | |
| B. | 过滤时,慢慢地将液体直接倒入过滤器中 | |
| C. | 可以用米汤检验含碘食盐中的碘元素 | |
| D. | 水银洒落时,可在其表面覆盖一层硫粉进行处理 |
分析 A.氯化铵加热易分解,冷却后又可生成氯化铵;
B.过滤时要用玻璃棒引流;
C.米汤的成分是淀粉,I2遇淀粉变蓝色;
D.水银能与硫粉反应,生成危害小的硫化汞.
解答 解:A.氯化铵加热易分解,冷却后又可生成氯化铵,碘加热时易升华,冷却后又生成碘固体,不能用加热的方法分离,故A错误;
B.在过滤时要用玻璃棒引流将液缓缓倒入过滤器中,故B错误;
C.米汤中含有淀粉,可用淀粉检验单质碘,但不能检验碘盐,因碘盐中的碘以碘酸钾的形式存在,故C错误;
D.水银洒落最好的处理方法是用硫粉撒在水银上,水银就会变成黑色结块状的硫化汞,这样对人体危害不大,故D正确.
故选D.
点评 本题考查物质的分离、提纯、检验,侧重于学生的分析能力、实验能力和评价能力的考查,难度不大,注意把握物质的性质的异同,注意除杂时不能引入新的杂质.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.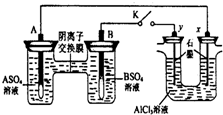 某同学按如图所示的装置进行实验. A、B为两种常见金属,它们的硫酸盐可溶于水.当 K 闭合时,在交换膜处SO42一从右向左移动.下列分析正确的是( )
某同学按如图所示的装置进行实验. A、B为两种常见金属,它们的硫酸盐可溶于水.当 K 闭合时,在交换膜处SO42一从右向左移动.下列分析正确的是( )
 某同学按如图所示的装置进行实验. A、B为两种常见金属,它们的硫酸盐可溶于水.当 K 闭合时,在交换膜处SO42一从右向左移动.下列分析正确的是( )
某同学按如图所示的装置进行实验. A、B为两种常见金属,它们的硫酸盐可溶于水.当 K 闭合时,在交换膜处SO42一从右向左移动.下列分析正确的是( )| A. | 溶液中(A2+)浓度减小 | |
| B. | B 的电极反应:B-2eˉ═B2+ | |
| C. | y 电极上有 H2 产生,发生还原反应 | |
| D. | 反应初期,x 电极周围出现白色胶状沉淀,不久沉淀溶解 |
2.阿司匹林是一种常用的退热、镇痛药物,其结构简式如图:下列有关阿司匹林的叙述正确的是( )
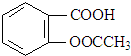

| A. | 阿司匹林的分子式为C9H8O4 | |
| B. | 阿司匹林苯环上的一氯取代物有2种 | |
| C. | 阿司匹林能与NaHCO3溶液反应,最多能与5 mol H2发生加成反应 | |
| D. | 1 mol 阿司匹林与足量NaOH溶液反应,最多消耗NaOH的量为2 mol |
19.下列气体中,有颜色的是( )
| A. | O2 | B. | Cl2 | C. | SO2 | D. | NH3 |
6.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.56 L甲烷中含有的共价键数为0.1NA | |
| B. | 标准状况下,1mol SO3含有的氧原子数为3NA | |
| C. | 3mol NO2和足量H2O反应,转移1 NA个电子 | |
| D. | pH=1的稀硫酸中含有的H+数为0.1NA |
16.常温下,物质的量浓度相同的三种盐NaX、NaY和NaZ溶液的pH值依次为8、9、10,则下列表达式错误的是( )
| A. | Z-+H2O═HZ+OH- | B. | HY+H2O═H3O++Y- | ||
| C. | 常温下,电离度:HX>HY>HZ | D. | HX+Z-→X-+HZ |
3.在下列各溶液中,离子一定能大量共存的是( )
| A. | pH=1的溶液中:Na+、Fe2+、NO3-、SO42- | |
| B. | 含Fe3+的溶液中:K+、Mg2+、S2-、NO3- | |
| C. | pH=13的溶液:Na+、K+、SiO32-、NO3- | |
| D. | 强碱性溶液中:K+、Al3+、Cl-、SO42- |
20.用NA表示阿佛加德罗常数,下列叙述正确的是( )
| A. | 56g铁被氧化时,失去电子数目一定是2NA | |
| B. | 常温常压下,71g Cl2中含电子总数为34NA | |
| C. | 标准状况下,2.24L SO3中,含分子总数为0.1NA | |
| D. | CnH2n+2分子中含有共价键数为(3n+1)NA |
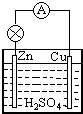 原电池是直接把化学能转化为电能的装置.如图所示:
原电池是直接把化学能转化为电能的装置.如图所示: