题目内容
18.下列各组物质的晶体中,晶体类型相同,化学键类型也完全相同的是( )| A. | CO2和SiO2 | B. | CCl4和Fe | C. | CaCl2和HCl | D. | SO3和SO2 |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,部分碱、大多数盐、金属氧化物及铵盐中都存在离子键,离子化合物中可能存在共价键;根据晶体的构成微粒判断晶体类型.
解答 解:A.二氧化碳为分子晶体,构成微粒是分子,分子中只存在共价键;二氧化硅属于原子晶体,构成微粒是原子,只存在共价键,故A错误;
B.四氯化碳是分子晶体,构成微粒是分子,只存在共价键,Fe是金属晶体,构成微粒是金属阳离子和电子,只存在金属键,故B错误;
C.氯化钙是离子晶体,构成微粒是离子,只存在离子键,氯化氢分子中只存在共价键,属于分子晶体,所以化学键类型不同,晶体类型不同,故C错误;
D.三氧化硫和二氧化硫都是分子晶体,构成微粒都是分子,分子中都只存在共价键,所以化学键类型及晶体类型相同,故D正确;
故选D.
点评 本题考查化学键及晶体类型判断,侧重考查学生分析判断能力及基本概念,明确物质构成微粒及微粒之间作用力即可解答,易错选项是A,题目难度不大.

练习册系列答案
相关题目
8.下列推断符合实际的是( )
| A. | 第n周期的最后一种金属元素处在第n-1族(1<n<7,n为正整数) | |
| B. | m=1和m=7(m为最外层电子数)的元素单质能形成的化合物都是离子化合物 | |
| C. | m-n=5(m为最外层电子数,n为电子层数)的主族元素存在最强的对应含氧酸 | |
| D. | 第n周期有n种主族金属元素(1<n<7,n为正整数) |
9.已知某酸H2B在水溶液中存在下列关系:①H2B?H++HB-,②HB-?H++B2-.关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是( )
| A. | NaHB属于弱电解质 | |
| B. | 溶液中的离子浓度c(Na+)>c(HB-)>c(H+)>c(OH-) | |
| C. | NaHB和NaOH溶液反应的离子方程式为H++OH-═H2O | |
| D. | c(Na+)=c(HB-)+c(B2-)+c(H2B) |
6.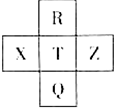 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:X<T<Q | B. | R与Q的电子数相差26 | ||
| C. | 气态氢化物稳定性:R<T<Q | D. | 简单离子的还原性:T>Q |
13.下列化学用语表示正确的是( )
| A. | 氧的原子结构示意图: | B. | 甲烷的比例模型: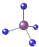 | ||
| C. | 硫化钾的电子式: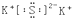 | D. | CO2的结构式:O-C-O |
3.把a L含碳酸铵、氯化铵的溶液分成两等份,一份需用b mol烧碱刚好把氨全部赶出,另一份与氯化钡溶液反应时,消耗c mol氯化钡,由此可知原溶液中Cl-的物质的量浓度是(单位:mol•L-1)( )
| A. | $\frac{b-2c}{a}$ | B. | $\frac{b-2c}{2a}$ | C. | $\frac{2b-c}{a}$ | D. | $\frac{2b-4c}{a}$ |
10.下列说法不正确的是( )
| A. | 元素分析可以鉴定有机物的实验式 | |
| B. | 用四氯化碳可以萃取乙酸水溶液中的乙酸 | |
| C. | 红外光谱分析可以鉴定有机物中含有的官能团或化学键 | |
| D. | 核磁共振氢谱分析可以鉴定有机物中不同化学环境的氢原子及它们的数目比 |
20.工业上用5.1t氨制取硝酸,理论上能生成63%在硝酸( )
| A. | 10t | B. | 11.9t | C. | 20t | D. | 30t |
 B.
B. C.
C. D.
D.
 与溴的四氯化碳溶液反应的化学反应方程式为
与溴的四氯化碳溶液反应的化学反应方程式为 .
. .
.