题目内容
6.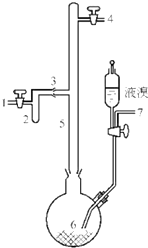 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].实验室制取无色的无水AlBr3(熔点:97.5℃,沸点:263.3~265℃)可用如图所示装置,主要实验步骤如下:
步骤l.将铝箔剪碎,用CCl4浸泡片刻,干燥,然后投入到烧瓶6中.
步骤2.从导管口7导入氮气,同时打开导管口l和4放空,一段时间后关闭导管口7和1;导管口4接装有五氧化二磷的干燥管.
步骤3.从滴液漏斗滴入一定量的液溴于烧瓶6中,并保证烧瓶6中铝过剩.
步骤4.加热烧瓶6,回流一定时间.
步骤5.将氮气的流动方向改为从导管口4到导管口l.将装有五氧化二磷的干燥管与导管口1连接,将烧瓶6加热至270℃左右,使溴化铝蒸馏进入收集器2.
步骤6.蒸馏完毕时,在继续通入氮气的情况下,将收集器2从3处拆下,并立即封闭3处.
(1)步骤l中,铝箔用CCl4浸泡的目的是除去铝箔表面的油脂等有机物.
(2)步骤2操作中,通氮气的目的是排出装置中含有水蒸气的空气.
(3)步骤3中,该实验要保证烧瓶中铝箔过剩,其目的是保证溴完全反应,防止溴过量混入溴化铝中.
(4)铝与液溴反应的化学方程式为2Al+3Br2=2AlBr3.
(5)步骤4依据何种现象判断可以停止回流操作当5的管中回流液呈无色或烧瓶6中物质呈无色.
(6)步骤5需打开导管口l和4,并从4通入N2的目的是将溴化铝蒸汽导入装置2中并冷凝得到溴化铝.
分析 (1)铝箔表面会有油污,根据相似相溶原理知,有机溶质易溶于有机溶剂;
(2)溴化铝易水解生成氢氧化铝和HBr;
(3)实验利用蒸馏方法得到溴化铝,如果溴过量,溴易混入溴化铝中;
(4)铝和溴反应生成溴化铝;
(5)溴完全反应后,5的管中回流液呈无色或烧瓶6中物质呈无色;
(6)将溴化铝蒸汽导入装置2中并冷凝得到溴化铝.
解答 解:(1)铝箔表面易沾有油脂,根据相似相溶原理知,有机溶质易溶于有机溶剂,所以用四氯化碳除去铝箔表面的油脂,故答案为:除去铝箔表面的油脂等有机物;
(2)溴化铝易水解生成氢氧化铝和HBr,为防止溴化物在空气中的水蒸气中水解,用氮气将水蒸气排出,故答案为:排出装置中含有水蒸气的空气;
(3)实验利用蒸馏方法得到溴化铝,如果溴过量,溴易混入溴化铝中,所以为保证液溴完全反应,该实验要保证烧瓶中铝箔过剩,
故答案为:保证溴完全反应,防止溴过量混入溴化铝中;
(4)铝和溴反应生成溴化铝,根据反应物、生成物书写方程式为2Al+3Br2=2AlBr3,故答案为:2Al+3Br2=2AlBr3;
(5)当5的管中回流液呈无色或烧瓶6中物质呈无色,说明溴恰好完全反应,则可以停止回流,
故答案为:当5的管中回流液呈无色或烧瓶6中物质呈无色;
(6)步骤5需打开导管口l和4,利用压强差将溴化铝蒸汽导入装置2并冷凝得到溴化铝,故答案为:将溴化铝蒸汽导入装置2中并冷凝得到溴化铝.
点评 本题考查制备实验方案设计,侧重考查学生对实验操作的分析评价,是对学生综合能力的考查,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.下列有关化学反应速率的说法中正确的是( )
| A. | 100 mL 2 mol•L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气速率不变 | |
| B. | 铁和稀硫酸反应制取氢气时,改用铁片和浓硫酸可加快产生氢气的速率 | |
| C. | 二氧化硫的催化氧化是一个放热反应,所以升高温度,反应速率减慢 | |
| D. | CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢 |
1.下列变化中,一定不存在化学能与热能相互转化的是( )
| A. | 铁丝燃烧 | B. | 白磷自燃 | C. | 燃放爆竹 | D. | 干冰气化 |
1.某校化学兴趣小组为探究铁与浓硫酸的反应,设计了图1、图2所示装置进行实验.
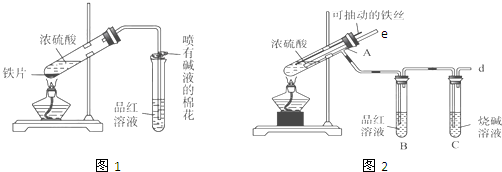
(1)能说明有SO2气体产生的实验现象是B中品红溶液褪色.
(2)图2中导气管e的主要作用为停止加热时,能防止倒吸或平衡压强.
(3)上述装置中图2中的NaOH溶液能吸收SO2尾气,防止污染,如将其更换为酸性KMnO4溶液,同样可以达到目的,试写出酸性KMnO4溶液与SO2反应的化学方程式:2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4.
(4)对比两套实验装置,不难发现图2装置除了能更好的吸收有毒气体SO2防止其污染环境外,还有一个非常明显的优点,你认为是便于控制反应的发生和停止.
(5)反应一段时间后停止反应,待冷却后用胶头滴管吸取A试管中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+.
为确认溶液的成分,选用如下试剂:
A.稀HCl溶液 B.稀硫酸 C.KSCN溶液 D.酸性KMnO4溶液E.NaOH溶液 F.H2O2溶液
试完成下列相关的实验探究:

(1)能说明有SO2气体产生的实验现象是B中品红溶液褪色.
(2)图2中导气管e的主要作用为停止加热时,能防止倒吸或平衡压强.
(3)上述装置中图2中的NaOH溶液能吸收SO2尾气,防止污染,如将其更换为酸性KMnO4溶液,同样可以达到目的,试写出酸性KMnO4溶液与SO2反应的化学方程式:2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4.
(4)对比两套实验装置,不难发现图2装置除了能更好的吸收有毒气体SO2防止其污染环境外,还有一个非常明显的优点,你认为是便于控制反应的发生和停止.
(5)反应一段时间后停止反应,待冷却后用胶头滴管吸取A试管中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+.
为确认溶液的成分,选用如下试剂:
A.稀HCl溶液 B.稀硫酸 C.KSCN溶液 D.酸性KMnO4溶液E.NaOH溶液 F.H2O2溶液
试完成下列相关的实验探究:
| 实验步骤 | 实验现象及结论 |
| 1、取一支洁净的试管,滴加1-2mL的试样溶液,再向试管中滴加几滴KSCN溶液 | (1)如果没有观察到溶液颜色有明显变化,则说明Ⅱ成立. (2)如果观察到溶液颜色转化为红色,则说明溶液中存在Fe3+,则Ⅰ或Ⅲ成立. |
| 2、 另取一支洁净的试管,加1-2mL试样溶液,用胶头滴管逐滴滴加酸性高锰酸钾溶液 | 如果滴加酸性高锰酸钾溶液后溶液的紫红色褪色,则说明溶液中含有亚铁离子,说明Ⅲ成立;如果滴加酸性高锰酸钾溶液后溶液紫红色不褪,则说明溶液中没有亚铁离子,说明Ⅰ成立. |
11.阿司匹林( 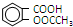 )是世界上应用最广泛的解热、镇痛药.因乙酸很难与酚羟基酯化,工业上以水杨酸(
)是世界上应用最广泛的解热、镇痛药.因乙酸很难与酚羟基酯化,工业上以水杨酸( 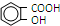 )与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林.粗产品中主要的副产物是水杨酸多聚物,需进一步提纯.反应原理和相关物理数据如下:
)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林.粗产品中主要的副产物是水杨酸多聚物,需进一步提纯.反应原理和相关物理数据如下:
 +(CH3CO)2O?浓硫酸△
+(CH3CO)2O?浓硫酸△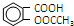 +CH3COOH
+CH3COOH
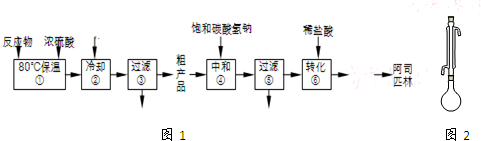
如图1是工业上制备并提纯阿司匹林的部分流程:
完成下列填空:
(1)步骤①的反应装置如图2所示(加热装置未画出),实验仪器必须干燥的原因是防止乙酸酐与水反应生成乙酸,不利于反应发生;冷凝管的作用是冷凝回流;对烧瓶进行加热的合适方法是水浴加热.
(2)反应中加入的乙酸酐是过量的,过量的目的是提高水杨酸的转化率;步骤②中加入水的目的是使乙酸酐转化为乙酸,同时放出大量的热,需冷却至常温再进行过滤,冷却的目的是减少阿司匹林因溶解而损失(使阿司匹林结晶析出);检验步骤③所得滤液中是否含有水杨酸,可选用的试剂是FeCl3.(写化学式)
(3)步骤④中加入NaHCO3的目的是使阿司匹林转化为易溶于水的盐.
(4)步骤⑤过滤得到的滤渣主要是水杨酸多聚物.步骤⑥中加入盐酸后发生反应的化学方程式为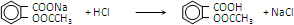 .
.
(5)从步骤⑥到成品纯阿司匹林的剩余操作依次有结晶、过滤、洗涤、干燥.
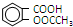 )是世界上应用最广泛的解热、镇痛药.因乙酸很难与酚羟基酯化,工业上以水杨酸(
)是世界上应用最广泛的解热、镇痛药.因乙酸很难与酚羟基酯化,工业上以水杨酸( 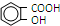 )与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林.粗产品中主要的副产物是水杨酸多聚物,需进一步提纯.反应原理和相关物理数据如下:
)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林.粗产品中主要的副产物是水杨酸多聚物,需进一步提纯.反应原理和相关物理数据如下: +(CH3CO)2O?浓硫酸△
+(CH3CO)2O?浓硫酸△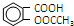 +CH3COOH
+CH3COOH| 名称 | 常温下状态 | 水中溶解性 |
| 乙酸酐 | 液 | 与水反应 |
| 阿司匹林 | 固 | 冷水中微溶;热水中易溶 |
| 水杨酸多聚物 | 固 | 难溶 |

完成下列填空:
(1)步骤①的反应装置如图2所示(加热装置未画出),实验仪器必须干燥的原因是防止乙酸酐与水反应生成乙酸,不利于反应发生;冷凝管的作用是冷凝回流;对烧瓶进行加热的合适方法是水浴加热.
(2)反应中加入的乙酸酐是过量的,过量的目的是提高水杨酸的转化率;步骤②中加入水的目的是使乙酸酐转化为乙酸,同时放出大量的热,需冷却至常温再进行过滤,冷却的目的是减少阿司匹林因溶解而损失(使阿司匹林结晶析出);检验步骤③所得滤液中是否含有水杨酸,可选用的试剂是FeCl3.(写化学式)
(3)步骤④中加入NaHCO3的目的是使阿司匹林转化为易溶于水的盐.
(4)步骤⑤过滤得到的滤渣主要是水杨酸多聚物.步骤⑥中加入盐酸后发生反应的化学方程式为
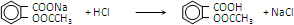 .
.(5)从步骤⑥到成品纯阿司匹林的剩余操作依次有结晶、过滤、洗涤、干燥.
15.现代科学又发现了H3、C60、C90、C240、N5、N60 …,据此可做出的推测是( )
①同一种元素可以形成多种单质
②单质可能存在复杂的分子结构
③单质的研究具有广阔的前景
④同种元素形成的单质之间可能存在更多的互相转化.
①同一种元素可以形成多种单质
②单质可能存在复杂的分子结构
③单质的研究具有广阔的前景
④同种元素形成的单质之间可能存在更多的互相转化.
| A. | 只有①② | B. | 只有②③ | C. | 只有③④ | D. | ①②③④ |
16.今年是我国科学家成功合成牛胰岛素50周年.1965年,中国科学院上海生物化学研究所、北京大学和的科学家通力合作在世界上第一次用人工方法合成出具有生物活性的蛋白质--结晶牛胰岛素.下列有关说法不正确的是( )
| A. | 人工牛胰岛素的合成,标志着人类在化学合成技术上迈出了重要的一步 | |
| B. | 牛胰岛素的水溶液可产生丁达尔效应 | |
| C. | 结晶牛胰岛素合成之前,应先确定每条链上氨基酸的排列顺序 | |
| D. | 结晶牛胰岛素双链之间通过肽键联接 |
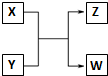 已知X、Y、Z、W分别是由短周期元素组成的四种微粒,它们之间有如图所示的转化关系,且X是一种含有18电子的微粒,Z是一种含有10电子的微粒.请回答下列问题:
已知X、Y、Z、W分别是由短周期元素组成的四种微粒,它们之间有如图所示的转化关系,且X是一种含有18电子的微粒,Z是一种含有10电子的微粒.请回答下列问题: