题目内容
5.2.3g某有机物A完全燃烧后,生成0.1mol CO2和2.7g H2O,测得该化合物的蒸气对氢气的相对密度为23,该化合物的核磁共振氢谱中出现一组峰,求该化合物的分子式、结构式.分析 根据该化合物的蒸气对氢气的相对密度可求得2.3g有机物的物质的量,根据CO2和H2O的质量判断2.3g有机物中是否含有O元素,并计算O原子的质量,进而计算C、H、O的物质的量比值,结合相对分子质量可得该有机物的化学式;再结合“该化合物的核磁共振氢谱中出现一组峰”判断其结构简式.
解答 解:n(CO2)=0.1mol,则2.3g有机物中:n(C)=n(CO2)=0.1mol,m(C)=0.1mol×12g/mol=1.2g,
n(H2O)=$\frac{2.7g}{18g/mol}$=0.15mol,则2.3g有机物中:n(H)=2n(H2O)=0.3mol,m(H)=0.3mol×1g/mol=0.3g,
因(1.2g+0.3g)<2.3g,
所以有机物中还应还用O元素,且m(O)=2.3g-1.2g-0.3g=0.8g,n(O)=$\frac{0.8g}{16g/mol}$=0.05mol,
则有机物中:n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2:6:1,
所以该有机物的最简式为C2H6O;
又该化合物的蒸气对氢气的相对密度是23,则M=2×23=46,
而C2H6O的相对分子质量为46,
所以该有机物的分子式为C2H6O,为乙醇或二甲醚,结构简式为:CH3CH2OH或CH3-O-CH3,
该化合物的核磁共振氢谱中出现一组峰,则该有机物结构简式为:CH3-O-CH3,结构式为: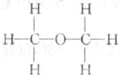 ,
,
答:该有机物的分子式为C2H6O,可能的结构简式为 .
.
点评 本题考查有机物分子式、结构简式的确定,题目难度中等,注意根据生成物的质量和有机物的质量判断有机物中是否含有O元素为解答该题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列各组离子在溶液中能大量共存的是( )
| A. | Ba2+、C1-、CO32-、K+ | B. | K+、OH-、HCO${\;}_{3}^{-}$、Na+ | ||
| C. | H+、Fe2+、MnO4-、Cl- | D. | Ca2+、HCO${\;}_{3}^{-}$、C1-、K+ |
16.下列说法中,正确的是( )
| A. | 氯原子和氯离子的化学性质相同 | B. | 一价氯负离子比氯原子多一个电子 | ||
| C. | 氯气有毒,氯离子也有毒 | D. | 氯气和氯离子都显黄绿色 |
13.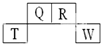 短周期元素Q、R、T、W在元素周期表中的位置如下,其中T原子的M层电子数比K层多2个,下列叙述不正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如下,其中T原子的M层电子数比K层多2个,下列叙述不正确的是( )
 短周期元素Q、R、T、W在元素周期表中的位置如下,其中T原子的M层电子数比K层多2个,下列叙述不正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如下,其中T原子的M层电子数比K层多2个,下列叙述不正确的是( )| A. | H2R2的分子中既含有极性共价键,又含有非极性共价键 | |
| B. | T的氧化物是一种良好的半导体材料 | |
| C. | Q、R的简单氢化物分子所含质子数、电子数与Ne分子相同 | |
| D. | Q的氢化物与W的氢化物反应有白烟现象,且生成物中既含有离子键,又含有共价键 |
20.下列叙述错误的是( )
| A. | 合金材料中可能含有非金属元素 | |
| B. | 光导纤维的主要成分是二氧化硅 | |
| C. | 金属氧化物均为碱性氧化物 | |
| D. | 不需要通过化学反应就能从海水中获得食盐和淡水 |
17.下列烷烃进行一氯代反应后,只生成3种沸点不同的产物的烷烃是( )
| A. | ( CH3)2CH( CH2)2 CH3 | B. | CH3 CH2 CH( CH3) CH2 CH3 | ||
| C. | ( CH3)2CHCH2CH( CH3)2 | D. | ( CH3)3 C CH2 CH3 |
14.胶体区别于其它分散系最本质的特征是( )
| A. | 外观均一 | B. | 能发生丁达尔效应 | ||
| C. | 很稳定 | D. | 分散系粒子直径介于10-9m~10-7m |
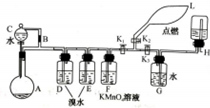 有一同学准备用Al4C3(含少量Mg2C3杂质)制取某种气种X(其装置图如图所示,夹持装置略),并进行以下实验项目:
有一同学准备用Al4C3(含少量Mg2C3杂质)制取某种气种X(其装置图如图所示,夹持装置略),并进行以下实验项目: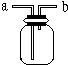 如图所示是中学化学实验中常见的装置,它有多种用途.
如图所示是中学化学实验中常见的装置,它有多种用途.