题目内容
4.Ⅰ、亚氯酸钠(NaClO2)可用以下流程制备.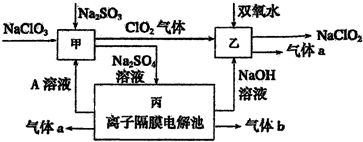
(1)A的化学式是H2SO4,甲中发生反应的化学方程式为Na2SO3+2NaClO3+H2SO4=2 ClO2↑+2Na2SO4+H2O.
(2)乙中反应的离子方程式是2ClO2+H2O2+2OH-═2ClO2-+O2↑+2H2O.
(3)装置丙产生气体b的电极反应式为2H++2e-=H2↑..
Ⅱ某溶液仅含下列离子中的几种,且所含各种离子的物质的量浓度均为0.1mol/L(忽略水的电离及离子的水解).
K+ Ag+ Mg2+ Al3+ NH4+ Cl- CO32- NO3- SO42- I-
用如下各步实验分析该溶液组成:
①取5mL溶液,滴少量稀氨水,发现溶液中有沉淀生成,且离子种类增加.
②用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,火焰不显紫色.
③另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色.
④向步骤③实验所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请回答下列问题:
(4)由步骤②判断,溶液中一定不含有的阳离子是K+;步骤③中生成无色气体的化学式是NO.
(5)最终确定溶液中所含阴离子有Cl-、I-、NO3-、SO42-.
(6)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体化学式为MgO.
分析 I.由流程图可知,丙是离子隔膜电解池,电解硫酸钠溶液本质是电解水,气体a与溶液A在同一电极得到,NaOH与气体b在另外电极得到,故A为硫酸,a为氧气,b为氢气,甲中NaClO3、Na2SO3、硫酸反应生成C1O2、Na2SO4溶液,反应离子方程式为:2H++SO32-+2ClO3-=2C1O2+SO42-+H2O,C1O2与过氧化氢在碱性条件下反应生成NaClO2和氧气;
Ⅱ.①取5mL溶液,滴加少量氨水,有沉淀生成,Ag+、Mg2+、Al3+ 离子至少含有一种,则CO32-一定不存在,该反应有NH4+生成,由于离子种类增加,说明增加的是NH4+,所以原溶液中一定不含NH4+;
②用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钻玻璃观察,无紫色火焰,说明溶液中不含K+;
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,说明有还原性离子I-与NO3-、H+反应生成NO,即溶液中有I-、NO3-,则判断一定不含有Ag+;
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成,说明有SO42-;
由上述分析可知,一定含有的阴离子I-、NO3-,SO42-,且各为0.1mol/L,依据电荷守恒可知,推断出的阳离子含有Mg2+、Al3+,其浓度为0.1mol/L,由电荷守恒可知溶液中还有一种-1价的阴离子为Cl-.
解答 解:I.由流程图可知,丙是离子隔膜电解池,电解硫酸钠溶液本质是电解水,气体a与溶液A在同一电极得到,NaOH与气体b在另外电极得到,故A为硫酸,a为氧气,b为氢气,甲中NaClO3、Na2SO3、硫酸反应生成C1O2、Na2SO4溶液,反应离子方程式为:2H++SO32-+2ClO3-=2C1O2+SO42-+H2O,C1O2与过氧化氢在碱性条件下反应生成NaClO2和氧气.
(1)由以上分析可知,A为H2SO4,甲中反应的化学方程式为:Na2SO3+2NaClO3+H2SO4=2 ClO2↑+2Na2SO4+H2O,
故答案为:H2SO4; Na2SO3+2NaClO3+H2SO4=2 ClO2↑+2Na2SO4+H2O;
(2)根据流程信息可知,生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原,则H2O2必定被氧化,有氧气产生,反应的离子方程式为:2ClO2+H2O2+2OH-═2ClO2-+O2↑+2H2O,
故答案为:2ClO2+H2O2+2OH-═2ClO2-+O2↑+2H2O;
(3)b为氢气,在电解池的阴极生成,电极方程式为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
Ⅱ.①取5mL溶液,滴加少量氨水,有沉淀生成,Ag+、Mg2+、Al3+ 离子至少含有一种,则CO32-一定不存在,该反应有NH4+生成,由于离子种类增加,说明增加的是NH4+,所以原溶液中一定不含NH4+;
②用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钻玻璃观察,无紫色火焰,说明溶液中不含K+;
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,说明有还原性离子I-与NO3-、H+反应生成NO,即溶液中有I-、NO3-,则判断一定不含有Ag+;
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成,说明有SO42-.
(4)步骤②用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钻玻璃观察,无紫色火焰,说明没有K+;③中加入少量盐酸生成无色气体,是I-与NO3-和H+反应生成NO,其离子方程式为:6I-+2NO3-+8H+═3I2+2NO↑+4H2O,
故答案为:K+;NO;
(5)由上述分析可知一定含有的阴离子I-、NO3-,SO42-,且各为0.1mol/L,依据电荷守恒可知,推断出的阳离子含有Mg2+、Al3+,其浓度为0.1mol/L,由电荷守恒可知溶液中还有一种-1价的阴离子为Cl-,所以甲同学最终确定原溶液中所含阳离子是:Mg2+、Al3+,阴离子是:Cl-、I-、NO3-、SO42-,
故答案为:Cl-、I-、NO3-、SO42-;
(6)另取100mL原溶液,加入足量的NaOH溶液,Mg2+、Al3+ 反应生成Mg(OH)2,NaAlO2,涉及的离子方程式为:Mg2++2OH-═Mg(OH)2↓、Al3++4OH-═AlO2-+2H2O,充分反应后过滤,洗涤,灼烧沉淀至恒重,沉淀为氢氧化镁,最终得到的固体为MgO,
故答案为:MgO.
点评 本题属于拼合型题目,涉及物质制备实验方案、离子共存与推断等,是对学生综合能力的考查,题目难度中等.

 应用题作业本系列答案
应用题作业本系列答案| A. | Ba2+、C1-、CO32-、K+ | B. | K+、OH-、HCO${\;}_{3}^{-}$、Na+ | ||
| C. | H+、Fe2+、MnO4-、Cl- | D. | Ca2+、HCO${\;}_{3}^{-}$、C1-、K+ |
(1)为了加快正反应速率,可以采取的措施有ABC(填序号,下同).
A.使用催化剂
B适当提高氧气的浓度
C.适当提高反应的温度
D.适当降低反应的温度
(2)如图能正确表示该反应中能量变化的是A.
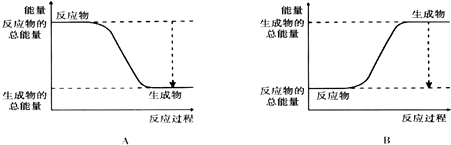
(3)从断键和成键的角度分析上述反应中能量的变化.
| 化学键 | H-H | O=O | H-O |
| 键能kJ.mol-1 | 436 | 496 | 463 |
| 化学键 | 填“吸收热量” 或“放出热量” | 能量变化kJ | |
拆开化学键 | 2molH2和1molO2中的化学键 | ||
| 形成化学键 | 4molH-O键 | ||
| 总能量变化 | |||
| A. | 氯原子和氯离子的化学性质相同 | B. | 一价氯负离子比氯原子多一个电子 | ||
| C. | 氯气有毒,氯离子也有毒 | D. | 氯气和氯离子都显黄绿色 |
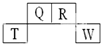 短周期元素Q、R、T、W在元素周期表中的位置如下,其中T原子的M层电子数比K层多2个,下列叙述不正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如下,其中T原子的M层电子数比K层多2个,下列叙述不正确的是( )| A. | H2R2的分子中既含有极性共价键,又含有非极性共价键 | |
| B. | T的氧化物是一种良好的半导体材料 | |
| C. | Q、R的简单氢化物分子所含质子数、电子数与Ne分子相同 | |
| D. | Q的氢化物与W的氢化物反应有白烟现象,且生成物中既含有离子键,又含有共价键 |
| A. | 外观均一 | B. | 能发生丁达尔效应 | ||
| C. | 很稳定 | D. | 分散系粒子直径介于10-9m~10-7m |