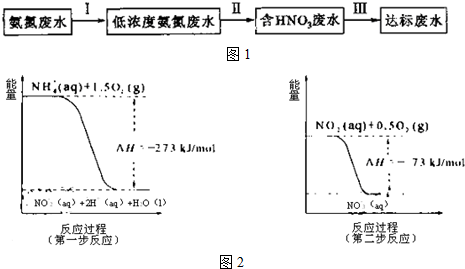
题目内容
1.在氯化铁溶液中存在下列平衡:FeCl3+3H2O?Fe(OH)3+3HCl;△H>0(1)加热FeCl3溶液,溶液的颜色会不断加深,可得到一种红褐色透明液体.向这种液体中加入MgCl2溶液,产生的现象为:生成红褐色沉淀.
(2)不断加热FeCl3溶液时,蒸干其水分并灼烧得到的固体可能是:Fe2O3.
(3)在配制FeCl3溶液时,为防止浑浊,应加入浓盐酸.
(4)向FeCl3溶液中加入少量浓苯酚钠溶液,预计可能看到的现象:得到红褐色沉淀,溶液呈紫色.
分析 (1)电解质能使胶体产生聚沉现象;
(2)加热蒸干挥发性酸的氯化铁溶液时生成弱碱氢氧化铁,灼烧氢氧化铁时生成氧化铁和水;
(3)FeCl3水解生成氢氧化铁,为防止FeCl3水解加入酸;
(4)向FeCl3溶液中加入少量浓苯酚钠溶液,铁离子和酚氧根离子发生双水解生成氢氧化铁和苯酚,苯酚遇到铁离子会反应生成紫色溶液.
解答 解:(1)氯化镁属于电解质,向氢氧化铁胶体中加入氯化镁溶液时易产生聚沉现象,从而生成红褐色氢氧化铁沉淀,
故答案为:生成红褐色沉淀;
(2)加热蒸干FeCl3溶液时,FeCl3水解生成氢氧化铁和HCl,加热促进HCl挥发,从而促进FeCl3水解,蒸干时得到氢氧化铁固体,灼烧氢氧化铁固体,氢氧化铁分解生成氧化铁和水,所以最终得到Fe2O3固体,
故答案为:Fe2O3;
(3)FeCl3水解生成氢氧化铁和HCl,为防止氯化铁水解,向溶液中滴加浓盐酸即可,
故答案为:浓盐酸;
(4)向FeCl3溶液中加入少量浓苯酚钠溶液,铁离子和酚氧根离子发生双水解生成红褐色沉淀氢氧化铁和苯酚,苯酚遇到过量的铁离子会反应生成紫色溶液;
故答案为:得到红褐色沉淀,溶液呈紫色.
点评 本题考查了盐类水解,题目难度中等,根据氯化铁水解生成物及其性质分析解答,注意加热蒸干生成挥发性酸的盐溶液时,达到固体碱,加热蒸干生成难挥发性酸的盐溶液时,得到原物质,为易错点.

练习册系列答案
相关题目
9.从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O
(1)为了加快正反应速率,可以采取的措施有ABC(填序号,下同).
A.使用催化剂
B适当提高氧气的浓度
C.适当提高反应的温度
D.适当降低反应的温度
(2)如图能正确表示该反应中能量变化的是A.
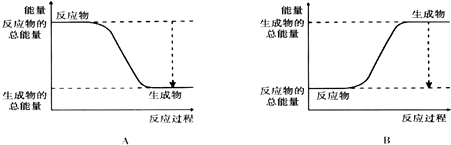
(3)从断键和成键的角度分析上述反应中能量的变化.
请填写下表:
(4)氢氧燃料电池的总反应方程式为2H2+O2=2H2O.其中,氢气在负极发生氧化反应.电路中每转移0.2mol电子,标准状况下消耗H2的体积是2.24L.
(1)为了加快正反应速率,可以采取的措施有ABC(填序号,下同).
A.使用催化剂
B适当提高氧气的浓度
C.适当提高反应的温度
D.适当降低反应的温度
(2)如图能正确表示该反应中能量变化的是A.

(3)从断键和成键的角度分析上述反应中能量的变化.
| 化学键 | H-H | O=O | H-O |
| 键能kJ.mol-1 | 436 | 496 | 463 |
| 化学键 | 填“吸收热量” 或“放出热量” | 能量变化kJ | |
拆开化学键 | 2molH2和1molO2中的化学键 | ||
| 形成化学键 | 4molH-O键 | ||
| 总能量变化 | |||
16.下列说法中,正确的是( )
| A. | 氯原子和氯离子的化学性质相同 | B. | 一价氯负离子比氯原子多一个电子 | ||
| C. | 氯气有毒,氯离子也有毒 | D. | 氯气和氯离子都显黄绿色 |
13.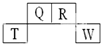 短周期元素Q、R、T、W在元素周期表中的位置如下,其中T原子的M层电子数比K层多2个,下列叙述不正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如下,其中T原子的M层电子数比K层多2个,下列叙述不正确的是( )
 短周期元素Q、R、T、W在元素周期表中的位置如下,其中T原子的M层电子数比K层多2个,下列叙述不正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如下,其中T原子的M层电子数比K层多2个,下列叙述不正确的是( )| A. | H2R2的分子中既含有极性共价键,又含有非极性共价键 | |
| B. | T的氧化物是一种良好的半导体材料 | |
| C. | Q、R的简单氢化物分子所含质子数、电子数与Ne分子相同 | |
| D. | Q的氢化物与W的氢化物反应有白烟现象,且生成物中既含有离子键,又含有共价键 |
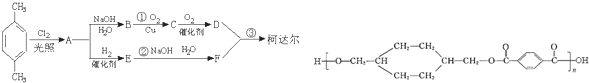
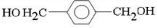 ;D
;D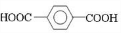 ;E
;E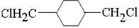
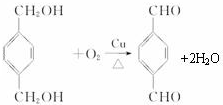 ,反应类型氧化反应
,反应类型氧化反应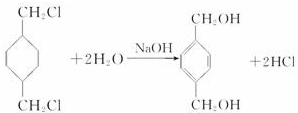 ,反应类型取代反应
,反应类型取代反应 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$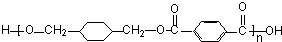 +(2n-1)H2O,反应类型缩聚反应.
+(2n-1)H2O,反应类型缩聚反应.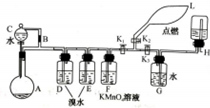 有一同学准备用Al4C3(含少量Mg2C3杂质)制取某种气种X(其装置图如图所示,夹持装置略),并进行以下实验项目:
有一同学准备用Al4C3(含少量Mg2C3杂质)制取某种气种X(其装置图如图所示,夹持装置略),并进行以下实验项目: