题目内容
8.根据等电子原理,由短周期元素组成的粒子,只要其原子数相同,各原子的最外层电子数之和也相同,可互称为等电子体.以下各组粒子不能互称为等电子体的是( )| A. | CO和N2 | B. | O3和SO2 | C. | CO2和N2O | D. | N2H4和C2H4 |
分析 根据具有相同原子数和价电子数的微粒之间互称等电子体,据此分析.
解答 解:A.CO和N2的原子个数都为2,价电子数前者为10,后者为10,原子数和价电子数都相等,属于等电子体,故A不选;
B.O3和SO2的原子个数都为3,价电子数前者为18,后者为18,原子数和价电子数都相等,属于等电子体,故B不选;
C.CO2和N2O的原子个数都为3,价电子数前者为16,后者为16,原子数和价电子数都相等,属于等电子体,故C不选;
D.N2H4和C2H4的原子个数都为6,价电子数前者为14,后者为12,原子数相等,但价电子数不相等,不属于等电子体,故D选;
故选D.
点评 本题考查了等电子体,充分理解等电子体的本质特征以及电子的计算方法是解答本题关键,难度中等.

练习册系列答案
相关题目
18.下列属于同分异构体的一组是( )
| A. | 35Cl和37Cl | B. | 白磷和红磷 | ||
| C. | H2O和 D2O | D. | 氰酸铵(NH4OCN)与尿素[CO(NH2)2] |
19.下列说法中正确的是( )
| A. | 如果找到合适的催化剂,就能够在不消耗能源的条件下从水中获得氢气 | |
| B. | 放热反应中反应物的总能量比生成物的总能量低 | |
| C. | 伴有能量变化的物质变化都是化学变化 | |
| D. | 吸热反应在不加热的条件下也能发生 |
16.下列叙述正确的是( )
| A. | NaHCO3与石灰水反应当n(NaHCO3):n[Ca(OH)2]=1:1时HCO3-完全转化为CaCO3 | |
| B. | CO2通入石灰水中,当n(CO2):n[Ca(OH)2]=1:1时,能得到澄清溶液 | |
| C. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=1:1时铝元素以AlO2-形式存在 | |
| D. | Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,溶液中存在Fe2+ |
3.下列说法中,错误的是( )
| A. | 人类目前所直接利用的能量大部分是由化学反应产生的 | |
| B. | 煤、石油、天然气是当今世界最重要的三种化石燃料 | |
| C. | 化学变化中的能量变化主要是由化学键变化引起的 | |
| D. | 化学反应中能量变化的大小与反应物的质量多少无关 |
13.依据元素周期表及元素周期律,下列推断正确的是( )
| A. | H2Se(硒化氢)比H2S稳定 | B. | Si、Ge(锗)均可做半导体材料 | ||
| C. | Mg(OH)2的碱性比Be(OH)2的弱 | D. | H3BO3(硼酸)的酸性比H2CO3的强 |
20.关于CO2说法正确的是( )
| A. | 碳原子采取sp1杂化 | B. | CO2是正四面体型结构 | ||
| C. | 干冰是原子晶体 | D. | CO2为极性分子 |
17.下列反应体系中,不属于可逆反应的是( )
| A. | SO2与水反应 | |
| B. | 氨气与水反应 | |
| C. | 工业合成氨 | |
| D. | 水电解生成H2和O2与H2在O2中燃烧生成H2O |
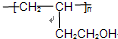 .
.