题目内容
5.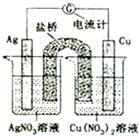 如图所示原电池的总反应为Cu(s)+2Ag+?Cu2+(aq)+2Ag(s) (盐桥中含有琼脂+饱和KNO3溶液,烧杯中的两溶液均为不饱和溶液),下列叙述正确的是( )
如图所示原电池的总反应为Cu(s)+2Ag+?Cu2+(aq)+2Ag(s) (盐桥中含有琼脂+饱和KNO3溶液,烧杯中的两溶液均为不饱和溶液),下列叙述正确的是( )| A. | 电子从铜电极经导线和盐桥流向银电极 | |
| B. | 电池工作时,K+向铜极的烧杯移动 | |
| C. | 工作一段时间后,右烧杯中溶液的pH变小 | |
| D. | 将AgNO3溶液更换为Fe(NO3)2溶液,电流计指针反向偏转 |
分析 A、Cu为负极Ag为正极,电子从负极经导线流向正极;
B、电池中阳离子移向正极;
C、硝酸铜水解显酸性,其浓度越大,水解导致溶液的酸性越强;
D、将AgNO3溶液更换为Fe(NO3)3溶液,Fe仍为负极.
解答 解:A、Cu为负极Ag为正极,电子从负极Cu经导线流向正极Ag,盐桥中无电子通过,故A错误;
B、原电池中阳离子移向正极,铜为负极,故B错误;
C、硝酸铜水解显酸性,Cu为负极,其失电子生成铜离子,导致铜离子浓度越大,其水解使溶液的酸性越强,pH减小,故C正确;
D、将AgNO3溶液更换为Fe(NO3)2溶液,Cu仍为负极,电流计指针偏转方向相同,故D错误;
故选C.
点评 本题考查原电池原理,难度不大,注意含有盐桥的原电池中,电极材料和其相应的盐溶液必须含有相同的金属元素,电子不进入电解质溶液中,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.可逆反应:3A(g)?3B(?)+C(?)(正反应为吸热反应),随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
①B和C可能都是固体 ②B和C一定都是气体
③若C为固体,则B一定是气体 ④B和C可能都是气体.
①B和C可能都是固体 ②B和C一定都是气体
③若C为固体,则B一定是气体 ④B和C可能都是气体.
| A. | ①④ | B. | ③④ | C. | ②③ | D. | ①② |
16.美国营养师布鲁索拿麦当劳“快乐儿童餐”做了个实验,结果发现购买的汉堡和薯条在一年内仍不变质,于是他指责麦当劳食品防腐剂太多.丙酸钠是常用的防腐剂之一,该物质可以由丙酸和烧碱反应制得.下列有关丙酸的说法不正确的是( )
| A. | 丙酸遇紫色石蕊试剂变红 | B. | 丙酸与乙醇的酯化反应是取代反应 | ||
| C. | 丙酸和乙酸互为同系物 | D. | 丙酸存在多种羧酸类同分异构体 |
20.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.1mol•L-1的Na2S溶液中,S2-的数目小于0.1NA | |
| B. | 0.1mol丙烷中含有的共价键数目为0.8NA | |
| C. | 标准状况下,11.2L甲醇中含有的分子数目为0.5NA | |
| D. | 0.1mol氧化钠和过氧化钠的混合物中含有的离子总数为0.3NA |
17.下列有关说法正确的是( )
| A. | SiO2既可与NaOH溶液反应也可与HF溶液反应,所以SiO2属于两性氧化物 | |
| B. | SO2溶于水后,其水溶液可以导电,所以SO2属于电解质 | |
| C. | 当光束照射云、烟、雾时,均可看到明显的光路,是因为三者都属于胶体 | |
| D. | 14CO2和12CO2具有相同的元素组成,所以14CO2、12CO2属于同素异形体 |
14.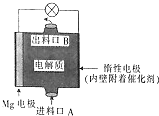 镁燃料电池是一种环境友好型的高性能电源,如图是Mg-NaClO燃料电池的示意图,电池总反应为Mg+ClO-+H2O═Cl-+Mg(OH)2↓,下列判断不正确的是( )
镁燃料电池是一种环境友好型的高性能电源,如图是Mg-NaClO燃料电池的示意图,电池总反应为Mg+ClO-+H2O═Cl-+Mg(OH)2↓,下列判断不正确的是( )
 镁燃料电池是一种环境友好型的高性能电源,如图是Mg-NaClO燃料电池的示意图,电池总反应为Mg+ClO-+H2O═Cl-+Mg(OH)2↓,下列判断不正确的是( )
镁燃料电池是一种环境友好型的高性能电源,如图是Mg-NaClO燃料电池的示意图,电池总反应为Mg+ClO-+H2O═Cl-+Mg(OH)2↓,下列判断不正确的是( )| A. | 惰性电极是该电池的正极 | |
| B. | 电解质中的多数ClO-向电池的负极移动 | |
| C. | 电池中发生的还原反应是Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓ | |
| D. | 进料口A进入的是NaClO溶液,而出料口B输出的则是NaCl溶液 |
20.XY2是由短周期元素形成的化合物,Y-比X2+多一个电子层,它与氩原子的电子层结构相同.下列有关叙述不正确的是( )
| A. | X是第二周期元素 | B. | Y是第ⅦA族元素 | ||
| C. | Y-与X2+的最外层电子数相同 | D. | 化合物XY2的化学键为离子键 |
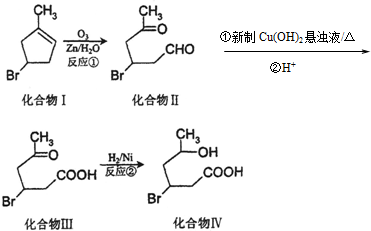
 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$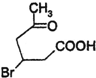 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.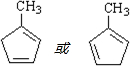 .
. .
.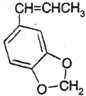 发生类似反应①的反应,得到乙醛和化合物Y,Y的结构简式为
发生类似反应①的反应,得到乙醛和化合物Y,Y的结构简式为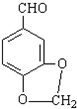 .
.