题目内容
20.XY2是由短周期元素形成的化合物,Y-比X2+多一个电子层,它与氩原子的电子层结构相同.下列有关叙述不正确的是( )| A. | X是第二周期元素 | B. | Y是第ⅦA族元素 | ||
| C. | Y-与X2+的最外层电子数相同 | D. | 化合物XY2的化学键为离子键 |
分析 XY2是由短周期元素形成的化合物,Y-比X2+多一个电子层,它与氩原子的电子层结构相同,则Y为Cl元素,Y-比X2+多一个电子层,则X的Mg元素,再结合物质的结构分析解答.
解答 解:XY2是由短周期元素形成的化合物,Y-比X2+多一个电子层,它与氩原子的电子层结构相同,则Y为Cl元素,Y-比X2+多一个电子层,X2+有两个电子层,X原子失去两个电子变为X2+,则X的Mg元素.
A.X是Mg元素,位于第三周期,故A错误;
B.Y是Cl元素,其最外层有7个电子,为ⅦA族元素,故B正确;
C.Y-与X2+的最外层电子数都是8,故C正确;
D.化合物MgCl2是由镁离子和氯离子构成的,氯离子和镁离子形成离子键,故D正确;
故选A.
点评 本题考查了原子结构和元素的性质,根据原子结构及离子所带电荷数确定元素,再结合元素所处周期、族来分析解答,难度不大.

练习册系列答案
相关题目
5.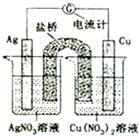 如图所示原电池的总反应为Cu(s)+2Ag+?Cu2+(aq)+2Ag(s) (盐桥中含有琼脂+饱和KNO3溶液,烧杯中的两溶液均为不饱和溶液),下列叙述正确的是( )
如图所示原电池的总反应为Cu(s)+2Ag+?Cu2+(aq)+2Ag(s) (盐桥中含有琼脂+饱和KNO3溶液,烧杯中的两溶液均为不饱和溶液),下列叙述正确的是( )
 如图所示原电池的总反应为Cu(s)+2Ag+?Cu2+(aq)+2Ag(s) (盐桥中含有琼脂+饱和KNO3溶液,烧杯中的两溶液均为不饱和溶液),下列叙述正确的是( )
如图所示原电池的总反应为Cu(s)+2Ag+?Cu2+(aq)+2Ag(s) (盐桥中含有琼脂+饱和KNO3溶液,烧杯中的两溶液均为不饱和溶液),下列叙述正确的是( )| A. | 电子从铜电极经导线和盐桥流向银电极 | |
| B. | 电池工作时,K+向铜极的烧杯移动 | |
| C. | 工作一段时间后,右烧杯中溶液的pH变小 | |
| D. | 将AgNO3溶液更换为Fe(NO3)2溶液,电流计指针反向偏转 |
15.某化学反应中,反应物B的物质的量浓度在20s内,从2.0mol/L变成了 1.Omol/L,则这20s内B的反应速率为( )
| A. | 0.05 | B. | 0.05mol/L | C. | 0.5 mol/(L.s) | D. | 0.05 mol/(L.s) |
5.下列烯烃中存在顺反异构体的是( )
| A. | 丙烯 | B. | 1-丁烯 | C. | 2-戊烯 | D. | 2-甲基-2-丁烯 |
12.在一定温度下,可逆反应X(g)+3Y(g)?2Z(g)达到平衡的标志是( )
| A. | X生成的速率与Z分解的速率相等 | |
| B. | 单位时间生成a molX,同时生成3a molY | |
| C. | X、Y、Z的分子数比为1:3:2 | |
| D. | X、Y、Z的浓度不再变化 |
 在温度T0下的2L密闭容器中,加入0.30mol SiC14、0.20mol N2、0.36mol H2进行反应:3SiCl4(g)+2N2(g)+6H2(g)?Si3N4(s)+12HCl(g)2min后达到平衡,测得固体的质量增加了2.80g
在温度T0下的2L密闭容器中,加入0.30mol SiC14、0.20mol N2、0.36mol H2进行反应:3SiCl4(g)+2N2(g)+6H2(g)?Si3N4(s)+12HCl(g)2min后达到平衡,测得固体的质量增加了2.80g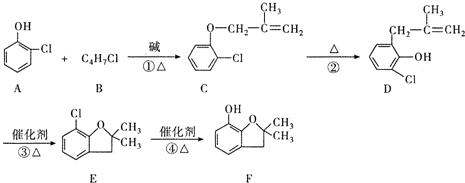
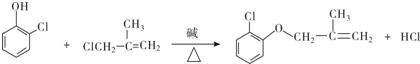 (有机物用结构简式表示,下同).
(有机物用结构简式表示,下同).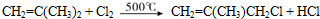
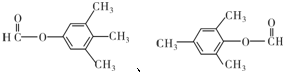

 .
. .
.