题目内容
10.已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大.其中A原子核外有三个未成对电子; B元素是地壳中含量最多的金属元素;C原子核外的M层中有两对成对电子;D是使用最广泛的合金的主要成分.E原子核外最外层只有1个电子,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)(1)E+离子的最外层电子排布式3s23p63d10,A、B、C的第一电离能最小的是Al
(2)A的最高价含氧酸分子中心原子是sp2杂化.
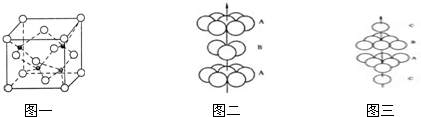
(3)A、B形成某种化合物的晶胞结构如下图一所示(“O”表示B原子),则其化学式为AlN,一个B原子周围距离最近且等距的B原子有12个.B原子的堆积方式与下图中的图三相同.(填“图二”或“图三”)
(4)1183K以下D晶体的晶胞为钾型,而1183K以上则转变为铜型,在两种晶胞中最邻近的D原子间距离相同,则两种晶体中原子的空间利用率之比为$\frac{3\sqrt{6}}{8}$(可用根号表示).
(5)开发新型储氢材料是氢能利用的重要研究方向.分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料.X一定不是BC(填标号).
A.H2O B.CH4 C.HF D.CO(NH2)2.
分析 A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大,B元素是地壳中含量最多的金属元素,则B是Al元素;
A原子核外有三个未成对电子,A为第VA族元素,A原子序数小于B,则A是N元素;
C原子核外的M层中有两对成对电子,则C是Si元素;
D是使用最广泛的合金的主要成分,则D是Fe元素;
E原子核外最外层只有1个电子,其余各层电子均充满,则E是Cu元素;
(1)E是Cu元素,其原子核外有29个电子,失去一个电子生成亚铜离子,M层为最外层,3s、3p、3d能级分别有2、6、10个电子;
A、B、C分别是N、Al、Si元素,元素的金属性越强,其第一电离能越小;
(2)A的最高价含氧酸是HNO3,N原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断N原子杂化方式;
(3)该晶胞中,铝离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氧离子个数=4,根据铝离子和氧离子个数之比确定化学式;
一个Al离子周围距离最近的Al离子个数=3×8×$\frac{1}{2}$;B晶胞是面心立方最密堆积;
(4)钾型晶胞中Fe原子个数=1+8×$\frac{1}{8}$=2,设Fe原子半径为x,晶胞棱长=$\sqrt{\frac{(4x)^{2}}{3}}$,晶胞体积=($\sqrt{\frac{(4x)^{2}}{3}}$)3,铁原子总体积=$\frac{4}{3}π{x}^{3}×2$,空间利用率=$\frac{\frac{4}{3}π{x}^{3}×2}{(\sqrt{\frac{(4x)^{2}}{3}})^{3}}$;
Cu型晶胞中铁原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,铁原子总体积=$\frac{4}{3}π{x}^{3}×4$,晶胞棱长=$\sqrt{\frac{(4x)^{2}}{2}}$,晶胞体积=($\sqrt{\frac{(4x)^{2}}{2}}$)3,空间利用率=$\frac{\frac{4}{3}π{x}^{3}×4}{(\sqrt{\frac{(4x)^{2}}{2}})^{3}}$;
(5)CH4分子间没有氢键,HF分子间只能形成链状结构.
解答 解:A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大,B元素是地壳中含量最多的金属元素,则B是Al元素;
A原子核外有三个未成对电子,A为第VA族元素,A原子序数小于B,则A是N元素;
C原子核外的M层中有两对成对电子,则C是Si元素;
D是使用最广泛的合金的主要成分,则D是Fe元素;
E原子核外最外层只有1个电子,其余各层电子均充满,则E是Cu元素;
(1)E是Cu元素,其原子核外有29个电子,失去一个电子生成亚铜离子,M层为最外层,3s、3p、3d能级分别有2、6、10个电子,亚铜离子最外层电子排布式为3s23p63d10;
A、B、C分别是N、Al、Si元素,元素的金属性越强,其第一电离能越小,这三种元素中金属性最强的是Al,所以第一电离能最小的是Al;
故答案为:3s23p63d10;Al;
(2)A的最高价含氧酸是HNO3,N原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论值N原子杂化方式为sp2,故答案为:sp2;
(3)该晶胞中,铝离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氧离子个数=4,铝离子和氧离子个数之比=4:4=1:1,所以化学式为AlN;
一个Al离子周围距离最近的Al离子个数=3×8×$\frac{1}{2}$=12;B晶胞是面心立方最密堆积,所以为图三,
故答案为:AlN;12;图三;
(4)钾型晶胞中Fe原子个数=1+8×$\frac{1}{8}$=2,设Fe原子半径为x,晶胞棱长=$\sqrt{\frac{(4x)^{2}}{3}}$,晶胞体积=($\sqrt{\frac{(4x)^{2}}{3}}$)3,铁原子总体积=$\frac{4}{3}π{x}^{3}×2$,空间利用率=$\frac{\frac{4}{3}π{x}^{3}×2}{(\sqrt{\frac{(4x)^{2}}{3}})^{3}}$;
Cu型晶胞中铁原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,铁原子总体积=$\frac{4}{3}π{x}^{3}×4$,晶胞棱长=$\sqrt{\frac{(4x)^{2}}{2}}$,晶胞体积=($\sqrt{\frac{(4x)^{2}}{2}}$)3,空间利用率=$\frac{\frac{4}{3}π{x}^{3}×4}{(\sqrt{\frac{(4x)^{2}}{2}})^{3}}$,则钾型与铜型原子利用率之比=$\frac{\frac{4}{3}π{x}^{3}×2}{(\sqrt{\frac{(4x)^{2}}{3}})^{3}}$:$\frac{\frac{4}{3}π{x}^{3}×4}{(\sqrt{\frac{(4x)^{2}}{2}})^{3}}$=$\frac{3\sqrt{6}}{8}$,
故答案为:$\frac{3\sqrt{6}}{8}$;
(5)CH4分子间没有氢键不能形成“笼状结构”,每个HF只能形成2个氢键,所以HF分子间只能形成链状结构,故选BC.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、氢键、原子核外电子排布、元素周期律等知识点,侧重考查计算能力及空间想象能力,难点是(4)题空间利用率的计算,正确判断哪几个原子紧贴在一起是解该题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案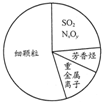
| A. | 燃烧反应的发生一定要用火去引燃 | |
| B. | 右图为雾霾的主要成分示意图,其中SO2和NxOy都属于酸性氧化物,重金属离子可导致蛋白质变性 | |
| C. | 塑料、合成橡胶和合成纤维是我们熟悉的三大合成材料,它们都是以石油、煤和天然气为原料生产的 | |
| D. | 化肥的使用有效地提高了农作物的产量,常见的氮肥可分为铵态氮肥和硝态氮肥,硝酸盐和尿素都属于硝态氮肥 |
 如图所示原电池的总反应为Cu(s)+2Ag+?Cu2+(aq)+2Ag(s) (盐桥中含有琼脂+饱和KNO3溶液,烧杯中的两溶液均为不饱和溶液),下列叙述正确的是( )
如图所示原电池的总反应为Cu(s)+2Ag+?Cu2+(aq)+2Ag(s) (盐桥中含有琼脂+饱和KNO3溶液,烧杯中的两溶液均为不饱和溶液),下列叙述正确的是( )| A. | 电子从铜电极经导线和盐桥流向银电极 | |
| B. | 电池工作时,K+向铜极的烧杯移动 | |
| C. | 工作一段时间后,右烧杯中溶液的pH变小 | |
| D. | 将AgNO3溶液更换为Fe(NO3)2溶液,电流计指针反向偏转 |
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
| A. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| B. | 四氯化碳的比例模型  | |
| C. | 氧原子的电子排布图 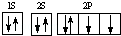 | |
| D. | ${\;}_{8}^{16}$O2-离子的结构示意图: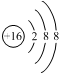 |
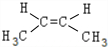
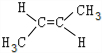
| A. | 丙烯 | B. | 1-丁烯 | C. | 2-戊烯 | D. | 2-甲基-2-丁烯 |
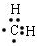 ;
;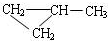 ;该产物中核磁共振氢谱峰面积(由小到大)之比为1:3:4.
;该产物中核磁共振氢谱峰面积(由小到大)之比为1:3:4.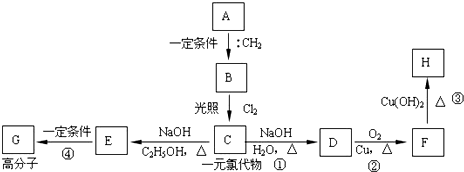
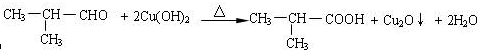 ;
; .
. 、
、 .
.