题目内容
【题目】污染性气体NO2与CO在一定条件下发生的反应为2NO2(g)+4CO(g)4CO2(g)+N2(g),310K下,向1L的恒温恒容密闭容器中充入0.1mol NO2和0.2mol CO,5min后反应达到平衡,此时NO2的浓度为0.05mol/L。
(1)反应从开始到5min时,CO的平均反应速率v(CO)=________,NO2的平衡转化率a=________,310K时,上述反应的平衡常数K=________。
(2)在350K下,重复上述实验,平衡后NO2的物质的量分数为30%,则该反应的ΔH________(填“>”“<“或“=”)0。
【答案】0.02mol/(Lmin) 50% 10 <
【解析】
(1)反应速率![]() ,
,![]() ,
,![]() ;
;
(2)和310K时NO2的物质的量分数比较判断反应进行的方向确定反应的焓变。
(1)污染性气体NO2与CO在一定条件下发生的反应为2NO2(g)+4CO(g)4CO2(g)+N2(g),310K下,向1L的恒温恒容密闭容器中充人0.1molNO2和0.2molCO,5min后反应达到平衡,此时2的浓度为0.05mol/L,结合三行计算列式:
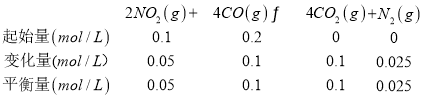 ,反应从开始到5min时,CO的平均反应速率
,反应从开始到5min时,CO的平均反应速率![]() ,NO2的平衡转化率
,NO2的平衡转化率![]() ,310K时,上述反应的平衡常数
,310K时,上述反应的平衡常数![]() ,故答案为:0.02mol/(Lmin);50%;10;
,故答案为:0.02mol/(Lmin);50%;10;
(2) 310K时,平衡后NO2的物质的量分数![]() ,在350K下,重复上述实验,平衡后NO2的物质的量分数为30%,二氧化氮物质的量分数增大,说明升温平衡逆向进行,正反应为放热反应,ΔH<0,故答案为:<。
,在350K下,重复上述实验,平衡后NO2的物质的量分数为30%,二氧化氮物质的量分数增大,说明升温平衡逆向进行,正反应为放热反应,ΔH<0,故答案为:<。

练习册系列答案
相关题目