题目内容
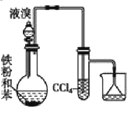
【题目】50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
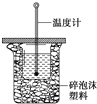
(1)从实验装置上看,图中尚缺少的一种玻璃用品是____________;
(2)用相同浓度和体积的醋酸代替稀盐酸溶液进行实验,求得的中和热数值__________(填“偏大”、“偏小”或“无影响”);
(3)实验中改用60mL 0.50mol/L 盐酸跟50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量_______(填“相等”或“不相等”),所求中和热_______(填“相等”或“不相等”)
【答案】环形玻璃搅拌棒 偏小 不相等 相等
【解析】
(1)根据量热计的构造来判断该装置的缺少仪器;
(2) 根据弱电解质电离吸热分析;
(3) 反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答。
(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,故答案为:环形玻璃搅拌器;
(2) 醋酸为弱酸,电离过程为吸热过程,所以用醋酸代替稀盐酸溶液反应,反应放出的热量小于57.3kJ,故答案为:偏小;
(3) 反应放出的热量和所用酸以及碱的量的多少有关,若用60mL 0.50mol/L 盐酸跟50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的值是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以测得中和热数值相等,故答案为:不相等;相等。

 名校课堂系列答案
名校课堂系列答案【题目】甲、乙两个恒容密闭容器中均发生反应:C(s)+2H2O(g)=CO2(g)+2H2(g)ΔH>0,有关实验数据如下表所示:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 平衡常数 | |
C(s) | H2O(g) | H2(g) | ||||
甲 | 2 | T1 | 2.0 | 4.0 | 3.2 | K1 |
乙 | 1 | T2 | 1.0 | 2.0 | 1.2 | K2 |
下列说法正确的是( )
A.K1=12.8
B.T1<T2
C.T1 ℃时向甲容器中再充入0.1 mol H2O(g),则平衡正向移动,CO2(g)的体积分数增大
D.若T2温度下,向2 L恒容密闭容器中充入1.0 mol CO2和2.0 mol H2,达平衡时,CO2的转化率大于40%