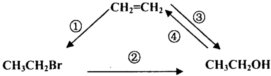
题目内容
16.在下列变化中,有共价键被破坏的是( )| A. | 碘升华 | B. | HCl溶于水 | ||
| C. | Zn跟硫酸铜溶液发生反应 | D. | 电解熔融NaCl |
分析 首先判断晶体的类型,明确晶体中粒子间的作用力,根据物质的变化判断共价键是否被破坏.
解答 解:A、碘属于分子晶体,升华时破坏分子之间的范德华力,故A错误;
B、氯化氢为共价化合物,溶于水电离成自由移动的离子,破坏的是共价键,故B正确;
C、Zn跟硫酸铜溶液发生反应,破坏金属键和离子键,故C错误;
D、氯化钠属于离子晶体,氯化钠熔化时破坏离子键,故D错误;
故选:B.
点评 本题考查化学键类型的判断,题目难度不大,注意晶体的类型,分子间作用力和化学键的区别.

练习册系列答案
相关题目
6.CO(g)与H2O(g)反应的能量变化如图所示,有关两者反应的说法正确的是( )
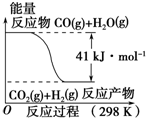

| A. | 该反应为吸热反应 | |
| B. | CO(g)和H2O(g)具有的总能量大于CO2(g)和H2(g)具有的总能量 | |
| C. | 该反应不需要加热就能进行 | |
| D. | 1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要放出41 kJ热量 |
7.下列说法中,正确的是( )
| A. | 1mol任何气体的体积都约是22.4L | |
| B. | 化学反应的本质就是原子之问的电子转移 | |
| C. | 在化学反应中,参加反应的各物质的质量比等于其物质的量之比 | |
| D. | 英国化学家波义尔提出元素的概念,标志着近代化学的诞生 |
4.下列说法正确的是( )
| A. | 活化分子间所发生的碰撞为有效碰撞 | |
| B. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大的主要原因之一是增加了单位体积内活化分子的百分数 | |
| D. | 有气体参与的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子总数,从而使反应速率增大 |
11.常用两种方法制备氯化物:①金属与氯气直接化合;②金属与盐酸反应.上述两种方法都可制得的氯化物是( )
| A. | CuCl2 | B. | ZnCl2 | C. | FeCl3 | D. | AlCl3 |
8.在下列各变化过程中,一定要加还原剂才能实现的是( )
| A. | HNO3→NO | B. | H2S→S | C. | FeCl2→FeCl3 | D. | SO32-→SO2 |
5.下列有关化学实验操作正确的是( )
| A. |  称取NaOH固体 | B. | 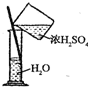 稀释浓H2SO4 | ||
| C. | 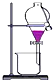 将乙醇与水分离 | D. | 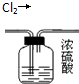 除去氯气中的水蒸气 |
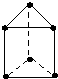 新合成的一种烃,其碳架呈三棱柱体(如图所示),小黑点表示碳原子,氢原子未标出.
新合成的一种烃,其碳架呈三棱柱体(如图所示),小黑点表示碳原子,氢原子未标出.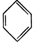 .
.