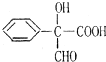
题目内容
7.下列说法中,正确的是( )| A. | 1mol任何气体的体积都约是22.4L | |
| B. | 化学反应的本质就是原子之问的电子转移 | |
| C. | 在化学反应中,参加反应的各物质的质量比等于其物质的量之比 | |
| D. | 英国化学家波义尔提出元素的概念,标志着近代化学的诞生 |
分析 A、在标准状况下,1mol任何气体的体积都约是22.4L;
B、化学反应的本质就是原子之间的重新组合;
C、在化学反应中,参加反应的各物质的物质的量之比等于其计量数之比;
D.英国化学家波义耳1661年提出化学元素的概念,标志着近代化学的诞生.
解答 解:A、在标准状况下,1mol任何气体的体积都约是22.4L,则在一定条件下,1mol任何气体的体积可能为22.4L,故A错误;
B、化学反应的本质就是原子之间的重新组合,故B错误;
C、在化学反应中,参加反应的各物质的质量比等于方程式中各物质化学计量数和该物质的相对分子质量乘积之比,故C错误;
D、英国化学家波义耳1661年提出化学元素的概念,标志着近代化学的诞生,故D正确.
故选D.
点评 本题考查较为综合,但比较简单,注意一些化学常识的积累.注意根据化学方程式进行计算时,已知物质的其他物理量一般可换算成物质的量,再根据化学方程式中的化学计量数之比等于物质的量之比分析解答.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
18.下列溶液中与100mL 1mol/L NaCl溶液中c(Cl-) 相同的是( )
| A. | 100 mL 1 mol/L AlCl3溶液 | B. | 200 mL 1 mol/L MgCl2溶液 | ||
| C. | 100 mL 0.5 mol/L CaCl2溶液 | D. | 100 mL 2 mol/L KCl溶液 |
2.能使湿润的淀粉KI试纸变蓝的是( )
①氯水 ②溴水 ③碘水 ④氯化钠 ⑤溴化钾.
①氯水 ②溴水 ③碘水 ④氯化钠 ⑤溴化钾.
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ③④⑤ |
12.某同学在实验室中进行如下实验:
以下结论正确的是( )
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 |  |  |  |
| 现象 | 没有明显变化 | 有沉淀生成,溶液为蓝色 | 有无色气体放出 |
| A. | Ⅰ中无明显变化,说明两溶液无离子反应 | |
| B. | Ⅱ中的白色沉淀为CuCl2 | |
| C. | Ⅱ中生成的BaSO4沉淀不是电解质 | |
| D. | Ⅲ中的离子方程式为2H++Zn═Zn2++H2↑ |
16.在下列变化中,有共价键被破坏的是( )
| A. | 碘升华 | B. | HCl溶于水 | ||
| C. | Zn跟硫酸铜溶液发生反应 | D. | 电解熔融NaCl |

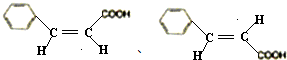
 ;
; ;
; 的最合理的方案.用合成反应流程图表示,书写模式如下:
的最合理的方案.用合成反应流程图表示,书写模式如下: