题目内容
6.写出下列转化的化学方程式,并注明反应条件和反应类型: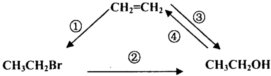
①CH2=CH2+HBr$\stackrel{催化剂}{→}$CH3CH2Br(加成反应);
②CH3CH2Br+NaOH$→_{△}^{水}$CH3CH2OH+NaBr(取代反应);
③CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH(加成反应);
④C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O(消去反应).
分析 ①乙烯与HBr发生加成反应生成溴乙烷;
②溴乙烷在氢氧化钠的水溶液中发生取代反应生成乙醇;
③乙烯与水发生加成反应生成乙醇;
④乙醇发生消去反应生成乙烯.
解答 解:①乙烯与HBr发生加成反应生成溴乙烷,CH2=CH2+HBr$\stackrel{催化剂}{→}$CH3CH2Br,属于加成反应,故答案为:CH2=CH2+HBr$\stackrel{催化剂}{→}$CH3CH2Br;加成;
②溴乙烷在氢氧化钠的水溶液中发生取代反应生成乙醇,CH3CH2Br+NaOH$→_{△}^{水}$CH3CH2OH+NaBr,故答案为:CH3CH2Br+NaOH$→_{△}^{水}$CH3CH2OH+NaBr;取代;
③乙烯含有碳碳双键,可与水在催化作用下发生加成反应生成乙醇,CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,加成;
④乙醇与浓硫酸加热到170℃发生消去反应生成乙烯,该反应为C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,故答案为:C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;消去;.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物中的官能团及官能团与性质的关系为解答的关键,侧重性质及有机反应方程式书写的考查,题目难度中等.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
16.在下列变化中,有共价键被破坏的是( )
| A. | 碘升华 | B. | HCl溶于水 | ||
| C. | Zn跟硫酸铜溶液发生反应 | D. | 电解熔融NaCl |
14.根据如图判断下列说法正确的是( )
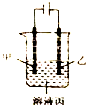

| A. | 若模拟铜的精炼原理,则乙为粗制 | |
| B. | 若模拟电镀原理,则甲为镀层金属 | |
| C. | 若模拟外加电流的阴极保护法防止金属腐蚀,则甲为被保护的金属 | |
| D. | 若甲、乙均为石墨,丙为稀硫酸,则通电一段时间后,硫酸的物质的两浓度减小 |
1.下列现象或反应的原理解释正确的是( )
| 现象或反应 | 原理解释 | |
| A | 锌与盐酸反应时,加入几滴氯化铜溶液可加快反应速率 | 氯化铜作反应的催化剂 |
| B | 将一小块金属钠投入水中,金属钠熔成小球 | 该反应△H>0 |
| C | 镀层破损后,镀锡铁比镀锌铁易腐蚀 | 锡比锌活泼 |
| D | 把铜片插入三氯化铁溶液中,在铜片表面不能出现一层铁 | Cu+2Fe3+=Cu2++2Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
11.锂和钠两种元素相比较,正确的是( )
| A. | 锂的还原性比钠的弱 | B. | 锂原子的半径比钠的大 | ||
| C. | 锂的金属性比钠的强 | D. | 锂单质的熔点比钠的低 |
18.下列说法正确的是( )
| A. | 原子的电子层数越多,原子半径一定越大 | |
| B. | 37号元素位于周期表中第五周期 | |
| C. | 同族元素相差的原子序数可能为16、26、36、46 | |
| D. | 卤族元素的单质均有氧化性,最高正价都是+7 |
15.符合C4H8O2分子式的同分异构体的化合物有( )
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
1.同温时,等物质的量浓度的下列溶液中,c(H+)最大的是( )
| A. | CH3COOH | B. | NaCl | C. | HCl | D. | Na2CO3 |