题目内容
17.在水溶液中能电离出大量Al3+的电解质是( )| A. | NaAlO2 | B. | KAl(SO4)2•12H2O | C. | Al(OH)3 | D. | Al2O3 |
分析 A.NaAlO2在水溶液中电离出钠离子和偏铝酸根离子;
B.KAl(SO4)2•12H2O在水溶液中电离出钾离子、铝离子和硫酸根离子;
C.氢氧化铝难溶于水;
D.氧化铝难溶于水.
解答 解:A.NaAlO2是强电解质,在水溶液中电离方程式为NaAlO2=Na++AlO2-,所以溶液中没有自由移动的铝离子,故A错误;
B.KAl(SO4)2•12H2O在水溶液中电离方程式为KAl(SO4)2.12H2O=K++Al3++2SO42-+12H2O,所以溶液中含有大量自由移动的铝离子,故B正确;
C.氢氧化铝难溶于水,则不能在溶液中电离出大量铝离子,故C错误;
D.氧化铝难溶于水,则不能在溶液中电离出大量铝离子,故D错误;
故选B.
点评 本题考查电解质在水溶液中的电离,为高频考点,明确电解质强弱及其溶解性是解本题关键,注意偏铝酸钠的电离方式,题目难度不大.

练习册系列答案
相关题目
12.有如下两个反应:(1)Cu+2Fe3+=Cu2++2Fe2+;(2)Fe+Cu2+=Fe2++Cu.判断Fe3+、Fe2+、Cu2+氧化性强弱顺序排列正确的是( )
| A. | Fe3+>Cu2+>Fe2+ | B. | Cu2+>Fe3+>Fe2+ | C. | Fe3+>Fe2+>Cu2+ | D. | Fe2+>Cu2+>Fe3+ |
2.有两个无标签的试剂瓶,分别装有Na2CO3和NaHCO3,有4位同学为鉴别它们采用了以下不同的方法,其中最可行的是( )
| A. | 分别配成溶液,再加入澄清石灰水 | |
| B. | 分别配成溶液,再加入CaCl2溶液 | |
| C. | 分别加热,再检验是否有使澄清石灰水变浑浊的气体产生 | |
| D. | 分别配成溶液,再进行焰色反应 |
9.下列说法正确的是( )
| A. | 1mol乙烯与Cl2完全加成,然后再与Cl2完全取代,共需5mol Cl2 | |
| B. | 乙烯、苯都能使溴水褪色,两者的褪色原理相同 | |
| C. | 2-丁烯不存在顺反异构体 | |
| D. | 研究有机物一般要经过的基本步骤为:分离、提纯→元素定量分析(确定实验式)→测定相对分子质量(确定分子式)→波谱分析(确定结构式),其中最早提出元素定量分析的是法国化学家李比希 |
7.下列离子方程式正确的是( )
| A. | MgSO4溶液中加入Ba(OH)2溶液:Ba2++SO42-=BaSO4↓ | |
| B. | FeCl3溶液中加入Cu粉:2Fe3++3Cu=2Fe+3Cu2+ | |
| C. | 酸性高锰酸钾溶液中滴加双氧水:2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O | |
| D. | 偏铝酸钠溶液中滴加NaHCO3溶液:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32- |
 医用氯化钙可用于生产补钙、抗过敏和消炎等药物.以工业碳酸钙为原料(含量为97.5%,含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙的主要流程如下:
医用氯化钙可用于生产补钙、抗过敏和消炎等药物.以工业碳酸钙为原料(含量为97.5%,含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙的主要流程如下: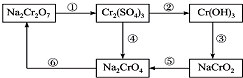 的H202,请与出该反应的离子方程式Cr2O72-+8H++3H2O2═2Cr3++3O2↑+7H2O
的H202,请与出该反应的离子方程式Cr2O72-+8H++3H2O2═2Cr3++3O2↑+7H2O .
.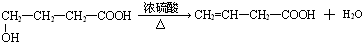 ;反应类型是:消去反应.利用C可以合成高分子化合物D,D的结构简式是:
;反应类型是:消去反应.利用C可以合成高分子化合物D,D的结构简式是: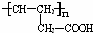 ;
; .
.