题目内容
17.写出下列有机反应的化学方程式,并指出反应类型.(1)工业上可采用乙烯水化法制取乙醇:CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH反应类型加成反应;
(2)乙醛与新制的氢氧化铜在加热条件下的反应:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O反应类型氧化反应;
(3)乙醇与乙酸在浓硫酸催化、加热条件下的反应:CH3COOH+C2H5OH
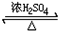 CH3COOC2H5+H2O反应类型取代反应;
CH3COOC2H5+H2O反应类型取代反应;(4)工业上由丙烯生产聚丙烯的反应:
 反应类型加聚反应.
反应类型加聚反应.
分析 (1)乙烯分子含有碳碳双键,能和水在催化剂条件下可发生加成反应生成乙醇;
(2)乙醛醛基具有还原性,能被新制氢氧化铜氧化,反应生成乙酸、氧化亚铜和水;
(3)乙酸与乙醇发生酯化反应(取代反应),酸脱羟基、醇脱氢生成乙酸乙酯和水;
(4)丙烯分子中含有碳碳双键,在一定条件下能够发生加聚反应生成聚丙烯,据此写出该反应的化学方程式.
解答 解:(1)乙烯和水在催化剂条件下可发生加成反应,反应的方程式为CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH,
故答案为:CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH;加成反应;
(2)在加热条件下,乙醛和新制氢氧化铜发生氧化反应生成乙酸、氧化亚铜和水,反应方程式为:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O,
故答案为:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O;氧化反应;
(3)乙酸与乙醇发生酯化反应属于取代反应,生成乙酸乙酯和水,反应为CH3COOH+C2H5OH 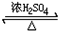 CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH 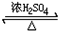 CH3COOC2H5+H2O;取代反应;
CH3COOC2H5+H2O;取代反应;
(4)聚丙烯分子中含有不饱和的碳碳双键,在一定条件下能够发生加聚反应得到聚丙烯,反应的化学方程式为: ,
,
故答案为: ;加聚反应.
;加聚反应.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重乙醇、醛、酸、烯性质的考查,注意发生的反应类型,题目难度不大.

练习册系列答案
 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
5.人造地球卫星用到的一种高能电池--银锌蓄电池,其电极分别是Ag2O和Zn,电解液是KOH溶液.放电时,该电池的电极反应式为Zn+2OH--2e-=Zn(OH)2,Ag2O+H2O+2e-=2Ag+2OH-.下列说法中正确的是( )
①锌为负极,Ag2O为正极;
②放电时,正极附近溶液OH-浓度增大;
③工作时电流由Ag2O极经外电路流向Zn极;
④溶液中阴离子向正极方向移动,阳离子向负极方向移动.
①锌为负极,Ag2O为正极;
②放电时,正极附近溶液OH-浓度增大;
③工作时电流由Ag2O极经外电路流向Zn极;
④溶液中阴离子向正极方向移动,阳离子向负极方向移动.
| A. | 只有① | B. | 只有②③ | C. | 只有①③④ | D. | 只有①②③ |
12.在雾霾天气的大气中能检测到多种有毒含氮化合物,如过氧乙酰基硝酸酯(PAN).大气中的烃类和NO2经过一系列光解反应生成过氧乙酰基,再与NO2化合形成PAN.该反应过程如下:

下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 夏季气温高,PAN含量高 | |
| B. | 气压低,化学平衡常数增大,PAN含量高 | |
| C. | 减少氮氧化物的排放可以减少PAN的含量 | |
| D. | 大气中灰尘可起催化作用,能提高过氧乙酰基的转化率 |
2.下列各组微粒中,核外电子总数相等的是( )
| A. | Na+和Li+ | B. | CO和CO2 | C. | H2O 和Al3+ | D. | NO和CO |
6.下列各组有机物只用一种试剂无法鉴别的是( )
| A. | 乙醇、苯酚、硝基苯 | B. | 苯、乙醛、己烯 | ||
| C. | 甲酸、甲苯、乙酸 | D. | 苯乙烯、甲苯、环己烷 |
7.下列表达式错误的是( )
| A. | 甲烷的电子式: | |
| B. | 氮原子的L层电子轨道表示式: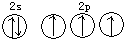 | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p4 | |
| D. | 碳-12原子:126C |
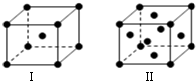 前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2.
前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2. ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③
,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③ 、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.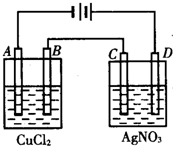 如图为以惰性电极进行电解:
如图为以惰性电极进行电解: