题目内容
7.下列表达式错误的是( )| A. | 甲烷的电子式: | |
| B. | 氮原子的L层电子轨道表示式: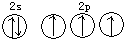 | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p4 | |
| D. | 碳-12原子:126C |
分析 A.碳与氢形成四对共用电子对;
B.根据洪特规则:电子排布在同一能级的不同轨道时优先单独占据一个轨道,且自旋方向相同;泡利原理:一个原子轨道里最多可容纳2个电子,且自旋方向相反;
C.硫离子的核外电子排布式:1s22s22p63s23p6,不是硫原子;
D.碳-12原子质子数为6,质量数为12.
解答 解:A.碳与氢形成四对共用电子对,故A正确;
B.由洪特规则和泡利原理可知,态氮原子L层电子的轨道表示式为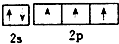 ,故B正确;
,故B正确;
C.硫离子的核外电子排布式:1s22s22p63s23p6,故C错误;
D.碳-12原子质子数为6,质量数为12,所以可表示为126C,故D正确.
故选C.
点评 本题考查化学用语,注意加强基础知识的积累,题目难度不大..

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案
相关题目
18.电子表所用的纽扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应式是:Zn+2OH--2e-═ZnO+H2O;Ag2O+H2O+2e-═2Ag+2OH-.总反应式为:Ag2O+Zn═2Ag+ZnO,下列说法正确的是( )
| A. | Zn为正极,Ag2O为负极 | |
| B. | Zn为负极,Ag2O为正极 | |
| C. | 原电池工作时,正极区溶液pH值减小 | |
| D. | 原电池工作时,负极区溶液pH值增大 |
15.在1mol/L的(NH4)2SO4溶液中,下列有关离子浓度大小比较中,正确的是( )
| A. | c(NH4+)=2c(SO42-)>c(H+)=c(OH-) | B. | c(NH4+)>c(SO42-)>c(H+)>c(OH-) | ||
| C. | c(SO42-)>c(NH4+)>c(H+)>c(OH-) | D. | c(SO42-)>c(NH4+)>c(OH-)>c(H+) |
2.下列化学用语使用正确的是( )
| A. | 丙烷分子的球棍模型是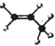 | B. | 2-氯甲苯的结构简式: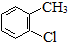 | ||
| C. | 乙醛分子的结构简式是CH3COH | D. | 葡萄糖、淀粉的最简式都是CH2O |
12.下列叙述正确的是( )
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | 金属阳离子被还原后,一定得到该元素的单质 | |
| C. | 核外电子总数相同的原子,一定是同种元素的原子 | |
| D. | 化合反应和置换反应均属于氧化还原反应 |
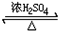 CH3COOC2H5+H2O反应类型取代反应;
CH3COOC2H5+H2O反应类型取代反应; 反应类型加聚反应.
反应类型加聚反应.
 把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中,有0.58g白色沉淀析出,向所得的浑浊液中,逐渐加入1mol/L盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示.则混合物中NaOH质量为( )
把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中,有0.58g白色沉淀析出,向所得的浑浊液中,逐渐加入1mol/L盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示.则混合物中NaOH质量为( )