题目内容
7. 前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2.
前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2.(1)六种元素中第一电离能最小的是K(填元素符号,下同),电负性最大的是N.
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂).请写出黄血盐的化学式K4[Fe(CN)6],1mol AB-中含有π键的数目为2NA,黄血盐晶体中各种微粒间的作用力不涉及def(填序号).
a.离子键 b.共价键 c.配位键
d.金属键 e.氢键 f.分子间的作用力
(3)E2+的价层电子排布图为
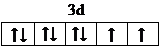 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③
,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③ 、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.(4)金属C、F晶体的晶胞结构如下图(请先判断对应的图),C、F两种晶体晶胞中金属原
子的配位数之比为2:3.金属C的晶胞中,若设该晶胞的密度为a g/cm3,阿伏加得罗常数为NA,C原子的摩尔质量为M,则表示C原子半径的计算式为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2M}{a{N}_{A}}}$cm.
分析 前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,则A为碳元素、B为N元素;C、D、E、F是位于同一周期的金属元素,只能处于第四周期,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,可推知C为K、F为Cu,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2,D、E价电子排布分别为3d64s2,3d84s2,故D为Fe、E为Ni,据此进行解答.
解答 解:前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,则A为碳元素、B为N元素;C、D、E、F是位于同一周期的金属元素,只能处于第四周期,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,可推知C为K、F为Cu,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2,D、E价电子排布分别为3d64s2,3d84s2,故D为Fe、E为Ni,
(1)六种元素中K的金属性最强,其第一电离能最小,非金属性越强电负性越大,故电负性最大的是N,
故答案为:K;N;
(2)黄血盐的化学式K4[Fe(CN)6],CN-与氮气互为等电子体,CN-中存在C≡N三键,故1mol CN-中含有π键的数目为2NA,黄血盐晶体中含有离子键、配位键、共价键,没有金属键、氢键、分子间的作用力,
故答案为:K4[Fe(CN)6];2NA;def;
(3)Ni2+的价层电子排布式为3d8,故价电子排布图为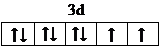
①CH2=CH2、③
HCHO分子的中心C原子采取sp2杂化,没有孤电子对,则其立体结构为平面三角形,它加成产物为甲醇,甲醇分子之间形成氢键,其熔、沸点比CH4的熔、沸点高,
故答案为: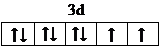
(4)金属K晶体为体心立方堆积,晶胞结构为图Ⅰ,晶胞中K原子配位数为8,金属Cu晶体为面心立方最密堆积,晶胞结构为图Ⅱ,以顶点Cu原子研究与之最近的原子位于面心,每个顶点Cu原子为12个面共用,晶胞中Cu原子配位数为12,K、Cu两种晶体晶胞中金属原子的配位数之比为 8:12=2:3;
金属K的晶胞中,K原子数目=1+8×$\frac{1}{8}$=2,若K原子的摩尔质量为M,阿伏加得罗常数为NA,则晶胞质量=$\frac{2×M}{{N}_{A}}$g,设该晶胞的密度为a g/cm3,则晶胞体积=$\frac{\frac{2M}{{N}_{A}}g}{ag•c{m}^{3}}$=$\frac{2M}{a{N}_{A}}$cm3,晶胞棱长=$\root{3}{\frac{2M}{a{N}_{A}}}$cm,设K原子半径为r,则晶胞体对角线长度=4r,故3($\root{3}{\frac{2M}{a{N}_{A}}}$cm)2=(4r)2,解得:r=$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2M}{a{N}_{A}}}$cm,
故答案为:2:3;$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2M}{a{N}_{A}}}$cm.
点评 本题考查了位置、结构与性质关系的综合应用、晶胞计算,题目难度较大,推断各元素为解答关键,注意明确原子结构与元素周期表、元素周期律的关系,(4)为难点,需要在学习中积累晶胞计算的方法与技巧.

| A. | 1 mol NH3分子中含有3NA个σ键和4NA个sp3杂化轨道 | |
| B. | 1 mol CO2分子中含有2NA个σ键和2NA个sp2杂化轨道 | |
| C. | 1 mol C2H2分子中含有2NA个σ键、2NA个π键 | |
| D. | 1 mol C2H4分子中含有4NA个σ键、2NA个π键 |
| A. | CH4>SiH4>GeH4>SnH4 | B. | KCl>NaCl>MgCl2>MgO | ||
| C. | Rb>K>Na>Li | D. | 金刚石>SiC>Si>S |
CH3-CH═CH-CH2-CH═CH2→CH3CHO+OHC-CH2-CHO+HCHO
CH3-C≡C-CH2-C≡CH-→CH3COOH+HOOCCH2COOH+HCOOH 某烃分子式为C10H10,在臭氧作用下发生反应:C10H10→CH3COOH+3HOOC-CHO+CH3CHO,
下列判断正确在是( )
| A. | 其结构中含有4个碳碳双键,4个碳碳三键 | |
| B. | 分子中含有4个碳碳双键和2个碳碳三键 | |
| C. | 该烃结构简式是:CH3-C≡C-CH=CH-C≡C-CH=CH-CH3 | |
| D. | 其结构中含有2个碳碳双键,4个碳碳三键 |
| A. | 苯和浓溴水用铁做催化剂制溴苯 | |
| B. | 甲烷与氯气光照制得纯净的一氯甲烷 | |
| C. | 实验室用CaC2和饱和食盐水制备乙炔 | |
| D. | 将苯与浓硝酸混合共热制硝基苯 |
| A. | 它是一种共价化合物 | |
| B. | 在加热时此化合物最终分解为PH3和HI | |
| C. | 这种化合物不能跟碱反应 | |
| D. | 该化合物可以由PH3和HI化合而成 |
| A. | MgBr2 | B. | NaOH | C. | K2O2 | D. | H2O2 |
 CH3COOC2H5+H2O反应类型取代反应;
CH3COOC2H5+H2O反应类型取代反应; 反应类型加聚反应.
反应类型加聚反应.