题目内容
9.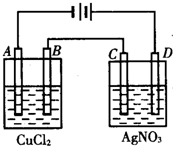 如图为以惰性电极进行电解:
如图为以惰性电极进行电解:(1)写出A、B、C、D各电极上的电极方程式:
ACu2++2e-═Cu
B2Cl--2e-═Cl2↑
C2Ag++2e-═2Ag
D4OH--4e-═2H2O+O2↑
(2)在A、B、C、D各电极上析出生成物的物质的量比为2:2:4:1
(3)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀.欲除去Cu2+,最好选用下列试剂中的b(填代号).
a.NaOH b.Zn c.Fe d.NH3•H2O.
分析 (1)A与电源负极相连,为阴极,铜离子在阴极得到电子;B为阳极,氯离子在阳极失去电子;D与电源正极相连为阳极,则氢氧根离子在阳极失去电子;C为阴极,银离子在阴极得到电子;
(2)转移电子相同,结合4e-~2Cu~2Cl2~4Ag~O2计算;
(3)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,Zn与Cu2+反应生成Cu,构成原电池会加速Zn电极的腐蚀;除去Cu2+,不能选择碱及引入杂质的物质,碱与锌离子也反应转化为沉淀.
解答 解:(1)由图可知,A、C为阴极,B、D为阳极,则A、B、C、D的电极反应分别为Cu2++2e-═Cu、2Cl--2e-═Cl2↑、2Ag++2e-═2Ag、4OH--4e-═2H2O+O2↑,
故答案为:Cu2++2e-═Cu;2Cl--2e-═Cl2↑;2Ag++2e-═2Ag;4OH--4e-═2H2O+O2↑;
(2)转移电子相同,由4e-~2Cu~2Cl2~4Ag~O2可知,若转移电子为4mol,A、B、C、D各电极上析出生成物的物质的量2mol、2mol、4mol、1mol,则A、B、C、D各电极上析出生成物的物质的量比为2:2:4:1,故答案为:2:2:4:1;
(3)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀的原因为锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀;除去Cu2+,不能选择碱,碱与锌离子也反应转化为沉淀,不能选Fe会引入新杂质亚铁离子,则只有Zn符合,故答案为:锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀;b.
点评 本题考查电解原理及应用,为高频考点,把握电极判断、离子放电顺序、电极反应、电子守恒等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
19.下列化合物中既有离子键又有极性键的是( )
| A. | MgBr2 | B. | NaOH | C. | K2O2 | D. | H2O2 |
20.现有三组混合液:①硝基苯和氢氧化钠溶液 ②苯和甲苯 ③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
4.38.4毫克铜跟适量的浓硝酸反应,铜全部作用后共收集到气体33.6毫升(标准状况),反应消耗的HNO3的物质的量可能是( )
| A. | 1.0×10-3摩尔 | B. | 1.6×10-3摩尔 | C. | 2.2×10-3摩尔 | D. | 2.7×10-3摩尔 |
14.下列对于反应3NO2+H2O=2HNO3+NO的说法中正确的是( )
| A. | 氧化剂与还原剂的质量比为1:2 | |
| B. | NO2是氧化剂水是还原剂 | |
| C. | 生成1molNO则有6mol电子发生转移 | |
| D. | 氧化剂与还原剂的物质的量比为2:1 |
1.下列装置能组成原电池的是( )
| A. |  | B. |  | C. |  | D. |  |
18.电子表所用的纽扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应式是:Zn+2OH--2e-═ZnO+H2O;Ag2O+H2O+2e-═2Ag+2OH-.总反应式为:Ag2O+Zn═2Ag+ZnO,下列说法正确的是( )
| A. | Zn为正极,Ag2O为负极 | |
| B. | Zn为负极,Ag2O为正极 | |
| C. | 原电池工作时,正极区溶液pH值减小 | |
| D. | 原电池工作时,负极区溶液pH值增大 |
 CH3COOC2H5+H2O反应类型取代反应;
CH3COOC2H5+H2O反应类型取代反应; 反应类型加聚反应.
反应类型加聚反应.