题目内容
12.在雾霾天气的大气中能检测到多种有毒含氮化合物,如过氧乙酰基硝酸酯(PAN).大气中的烃类和NO2经过一系列光解反应生成过氧乙酰基,再与NO2化合形成PAN.该反应过程如下:
下列有关说法正确的是( )
| A. | 夏季气温高,PAN含量高 | |
| B. | 气压低,化学平衡常数增大,PAN含量高 | |
| C. | 减少氮氧化物的排放可以减少PAN的含量 | |
| D. | 大气中灰尘可起催化作用,能提高过氧乙酰基的转化率 |
分析 A.根据该反应放热,温度高反应向逆反应方向进行;
B.该反应为气体减小的反应,气压低,平衡向逆反应方向进行,化学平衡常数减小;
C.减少氮氧化物的排放,相当于减少反应物浓度,平衡逆向移动;
D.催化剂只改变反应速率,不改变平衡移动.
解答 解:A.因为该反应放热,温度高反应向逆反应方向进行,所以夏季气温高,PAN含量低,故A错误;
B.该反应为气体减小的反应,气压低,平衡向逆反应方向进行,化学平衡常数减小,PAN含量低,故B错误;
C.减少氮氧化物的排放,相当于减少反应物浓度,平衡逆向移动,所以可以减少PAN的含量,故C正确;
D.催化剂只改变反应速率,不改变平衡移动,所以灰尘起催化作用,不能提高过氧乙酰基的转化率,故D错误;
故选C.
点评 本题以信息的形式考查平衡移动原理,侧重利用移动原理来分析与迁移应用能力的考查,题目难度不大.

练习册系列答案
相关题目
2.下列实验能获得成功的是( )
| A. | 苯和浓溴水用铁做催化剂制溴苯 | |
| B. | 甲烷与氯气光照制得纯净的一氯甲烷 | |
| C. | 实验室用CaC2和饱和食盐水制备乙炔 | |
| D. | 将苯与浓硝酸混合共热制硝基苯 |
3.某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.
(1)请完成以下实验设计表(表中不要留空格):
(2)编号①实验测得容器中压强随时间变化如图2.t2时,容器中压强明显小于起始压强,其原因是铁发生了吸氧腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了还原(填“氧化”或“还原”)反应,其电极反应式是O2+2H2O+4e-=4OH-.
(3)经过相当长的一段时间,图1锥形瓶中混合物表面生成了一层红棕色的铁锈,取少量铁锈于试管中,加入稀盐酸,取少量反应之后的溶液检验其中的Fe3+,检验Fe3+最灵敏的试剂是大家熟知的KSCN,可以检验痕量的Fe3+.还可用KI来检验:2Fe3++2I-?2Fe2++I2,有资料认为这可能是一个可逆反应.Fe3+,进而证明这是否是一个可逆反应,试利用实验室常用仪器、用品及以下试剂设计方案并填写位于答题卷的下表.0.1mol/L的FeCl3、KI、KSCN、NaOH、H2SO4、KMnO4溶液,CCl4,蒸馏水.

(1)请完成以下实验设计表(表中不要留空格):
| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 醋酸浓度的影响 | 0.5 | 36.0 | |
| ③ | 0.2 | 2.0 | 90.0 |
(3)经过相当长的一段时间,图1锥形瓶中混合物表面生成了一层红棕色的铁锈,取少量铁锈于试管中,加入稀盐酸,取少量反应之后的溶液检验其中的Fe3+,检验Fe3+最灵敏的试剂是大家熟知的KSCN,可以检验痕量的Fe3+.还可用KI来检验:2Fe3++2I-?2Fe2++I2,有资料认为这可能是一个可逆反应.Fe3+,进而证明这是否是一个可逆反应,试利用实验室常用仪器、用品及以下试剂设计方案并填写位于答题卷的下表.0.1mol/L的FeCl3、KI、KSCN、NaOH、H2SO4、KMnO4溶液,CCl4,蒸馏水.
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 在试管中加入少量该FeCl3溶液和过量(填少量、过量)的KI溶液. | 深红色如期出现 |
| ② | 将试管中的混合溶液转移至分液漏斗(填仪器)中,倒入一定量的CCl4,塞住活塞,充分振荡(萃取),静置. | 液体分层,上层接近无色,下层紫红色 |
| ③ | 打开活塞,先放出下层液体,再从分液漏斗的上口中倒出水层于试管中,加入KSCN溶液 | 出现血红色,则反应后的混合物中含Fe3+,进而证明这的确是一个可逆反应;反之则不含Fe3+,进而证明不是一个可逆反应 |

20.现有三组混合液:①硝基苯和氢氧化钠溶液 ②苯和甲苯 ③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
7.气态反应 A(g)+3B(g)═2C(g)+2D(g),在四种不同条件下的反应速率最快的是( )
| A. | v(A)=0.15 mol/(L•s) | B. | v(B)=0.8 mol/(L•s) | C. | v(C)=0.4 mol/(L•s) | D. | v(D)=0.6 mol/(L•s) |
4.38.4毫克铜跟适量的浓硝酸反应,铜全部作用后共收集到气体33.6毫升(标准状况),反应消耗的HNO3的物质的量可能是( )
| A. | 1.0×10-3摩尔 | B. | 1.6×10-3摩尔 | C. | 2.2×10-3摩尔 | D. | 2.7×10-3摩尔 |
1.下列装置能组成原电池的是( )
| A. |  | B. |  | C. |  | D. |  |
2.下列化学用语使用正确的是( )
| A. | 丙烷分子的球棍模型是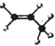 | B. | 2-氯甲苯的结构简式: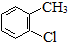 | ||
| C. | 乙醛分子的结构简式是CH3COH | D. | 葡萄糖、淀粉的最简式都是CH2O |
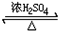 CH3COOC2H5+H2O反应类型取代反应;
CH3COOC2H5+H2O反应类型取代反应; 反应类型加聚反应.
反应类型加聚反应.