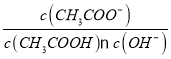题目内容
【题目】下列实验操作、现象和所得结论均正确的是( )
选项 | 实验内容 | 实验结论 |
A | 向盛有5mL0.005mol/L FeCl3溶液中加入5mL0.01mol/LKSCN溶液,再继续加入少量KCl固体,观察现象 | 证明溶液存在平衡: FeCl3+3KSCNFe(SCN)3+3KCl |
B | 取两只试管,分别加入等体积等浓度的双氧水,然后试管①中加入0.01mol/LFeCl3溶液2mL,试管②中加入0.01mol/LCuCl2溶液2mL,试管①产生气泡快 | 加入FeCl3时,双氧水分解反应的活化能较大 |
C | 检验FeCl3溶液中是否含有Fe2+时,将溶液滴入酸性KMnO4溶液,溶液紫红色褪去 | 不能证明溶液中含有Fe2+ |
D | 取两只试管分别加入4mL0.01mol/LKMnO4酸性溶液,然后向一只试管中加入0.01mol/L H2C2O4溶液2mL,向另一只试管中加入0.01mol/L H2C2O4溶液4mL,第一只试管中褪色时间长 | H2C2O4浓度越大,反应速率越快 |
A.AB.BC.CD.D
【答案】C
【解析】
A.FeCl3+3KSCNFe(SCN)3+3KCl对应的离子方程式为:![]() ,KCl没有参与反应,加入少量的氯化钾固体,对平衡移动无影响,不能证明存在平衡状态,故A错误;
,KCl没有参与反应,加入少量的氯化钾固体,对平衡移动无影响,不能证明存在平衡状态,故A错误;
B.催化剂对反应速率的影响是降低了反应的活化能,加快反应速率,因此速率越快说明活化能越低,故B错误;
C.酸性条件下,高锰酸钾能氧化氯离子,溶液紫红色褪去不能说明含有亚铁离子,故C正确;
D.所用草酸溶液的体积不同,导致混合后高锰酸钾的浓度不同,且生产的锰离子可作催化剂,则不能说明H2C2O4浓度越大,反应速率越快,故D错误;
故选:C。

【题目】Ⅰ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)![]() 2NH3(g)
2NH3(g)
(1)已知每破坏1mol有关化学键需要的能量如下表:
H-H | N-H | N-N | N≡N |
435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
(1)则反应物的总能量_________(填“>”或 “<”)生成物的总能量
(2)在一定温度下、向2L密闭容器中加入2 molN2、6 mol H2,在适当的催化剂作用下,发生反应 N2 (g)+3H2 (g)![]() 2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
①下列叙述能说明此反应达到平衡状态的是________________________。
a.容器内总压强不变 b.v(H2)正=v(H2)逆 c.N2和H2的浓度相等
d. 2 mol NH3生成的同时有3 moH—H键断裂 e.NH3的浓度不再改变
②0~10 min内的平均反应速率v(H2) 是______mol/(Lmin);10秒末NH3的浓度是______mol/L;N2 的的物质的量________mol
Ⅱ.某温度时,在一个2L的密闭容器中X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,据此回答:
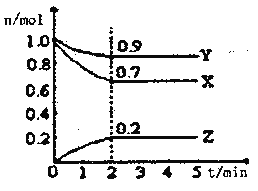
(1)该反应的化学方程式为_______________________
(2)从开始至2min,Z的平均反应速率为____________mol/(L·min);
(3)改变下列条件,可以加快化学反应速率的有_________
A.升高温度 B.减小物质X的物质的量
C.减小压强 D.增加物质Z的物质的量.
E.加入某种催化剂 F.缩小容积 G.使用效率更高的催化剂
(4)该反应正向为放热反应若上述容器为绝热容器(与外界无热交换),则到达平衡所需时间将_________。
a.延长 b.缩短 c.不变 d.无法确定